Навигация
Полиакриламидный гель (ПААГ)
Реферат на тему:
Полиакриламидный гель (ПААГ)
2009
1. Полиакриламидный гель (ПААГ)
Это — продукт полимеризации акриламида. В результате разрывов двойных связей и конденсации по ним получаются длинные бесцветные нити линейного полимера полиакриламида. Эти нити могут быть ковалентно связаны («сшиты») между собой.
Конечно, в реальных полимерах нити полиакриламида вовсе не параллельны, а расположены хаотически, но в отдельных точках своего сближения они сшиты мостиками «Биса». Получаются неправильной формы поры пространственной решетки, средний размер которых, тем не менее, определяется частотой расположения сшивок и концентрацией основных нитей полимеров.
Оба мономера: акриламид и «Бис» представляют собой хорошо растворимые в водной среде порошки. Образование пространственной сетки геля происходит прямо в растворе выбранного буфера, который благодаря этому заполняет все поры геля.
Полимеризацию стимулируют добавки в малых количествах еще двух веществ. Одно из них служит инициатором процесса полимеризации, второе — ускоряет этот процесс.
Содержание водной фазы в геле очень велико — от 70 до 97%.
Пористость и механические характеристики ПААГ задают путем выбора процентного отношения суммарной массы обоих полимеров к объему геля. Эту величину принято обозначать буквой Т. Практически она варьирует от 3 до 30%. Вес сшивки («Биса») составляет обычно от 1 до 5% суммарного веса мономе-ров. Эту величину обозначают буквой С. При малых значениях сшивки (С<2%) ПААГ нельзя считать жесткой регулярной пространственной решеткой. Скорее это — длинные нити, лишь в отдельных точках, случайным образом связанные между собой. Расстояние между этими точками вдоль нити в среднем составляет 50—100 мономерных единиц. Мигрирующие в геле молекулы белка могут раздвигать длинные, гибкие участки линейных полимеров акриламида. На это расходуется энергия, что также сказывается замедлением миграции.
ПААГ хорошо прилипает к чисто вымытому стеклу.
В свободной жидкости скорость миграции большинства кислых белков при рН8,5 составляет 0,1-0,5 см/час при напряженности поля 1 В/см. Для эффективного разделения белков в ПААГ, как показывает опыт, средняя скорость их миграции (благодаря сопротивлению геля) должна быть в 5-10 раз меньше. При нормальной напряженности электрического поля в 10-20 В/см этому соответствует средняя скорость миграции белков в геле порядка 0,1-2 см/час. Таким образом, при рабочей длине геля в 20 см за 10 часов электрофореза наиболее быстрые белки могут достигнуть нижнего конца геля в то время, как наиболее медленные продвинутся лишь на 1 см. Напряжение, которое при этом должно подаваться на трубочку геля, составит 200—400 В. Цифры эти, конечно, сугубо ориентированные.
Выбор значения Т зависит от характера электрофоретических подвижностей белков в геле. Если сильно различаются размеры белковых молекул, а отношение заряда к массе у них более или менее одинаковое, то имеет смысл выбрать Т максимальным. Разделение в этом случае будет происходить в основном за счет трения о гель. Причем тем эффективнее, чем больше Т, хотя при этом в связи с увеличением продолжительности электрофореза усилится диффузия белков в полосах. Если же компоненты анализируемой смеси имеют заведомо различные отношения заряда к массе, то может оказаться выгодным вести разделение в крупнопористом геле (при малых значениях Т), то есть как бы в свободной жидкости.
В качестве сугубо ориентировочной можно рекомендовать следующую, полученную на практике, таблицу соответствия молекулярных масс разделяемых белков (М) и концентраций ПААГ (Т):
М (тыс. дальтон) Т (%) 10-40 15-20 40-100 10-15 100-300 5-10 >300 5
2. Электрофорез белков в вертикальных пластинах
Первые опыты с электрофорезом белков ставились в вертикально стоящих трубочках. Для простоты изложения я в этой системе рассматривал и основные особенности электрофореза, не зависящие от формы геля. Однако в ходе эксплуатации довольно скоро выяснилось, что система трубочек неудобна в двух отношениях. Во-первых, в трубочке трудно добиться одинакового охлаждения геля по всему ее сечению. Во-вторых, для сравнения результатов электрофореза нескольких сопоставляемых препаратов белков нужно было приготовить столько же отдельных трубочек в совершенно одинаковых условиях состава и полимеризации ПААГ, что затруднительно. Поэтому с середины 70-х годов электрофорез белков ведут исключительно в вертикально расположенных пластинах (рис. 1).
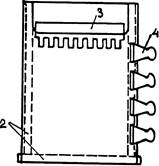
2-ПРОКЛАДКИ; 3-ПЛЕНКА; 4-ЗАЖИМ
Рис. 1
Обычно используют пластины шириной 8-14 см и длиной до 30 см. Полимеризацию акриламида, а затем и сам электрофорез ведут в форме, образованной двумя пластинами зеркального стекла толщиной 5 мм. Переднее стекло (на рис. 37) имеет вырез, назначение которого будет ясно из дальнейшего.
Расстояние между пластинами, — а значит и толщина геля, — задается толщиной прокладок из тефлона (0,4-1,5 мм) при ширине 10-15 мм (на рисунке они показаны пунктиром). Эти прокладки устанавливают по бокам и внизу формы, при условии плотного прилегания нижней прокладки к торцам боковых. Нижняя прокладка — немного выступает за пределы формы, поскольку после затвердевания геля ее надлежит удалить. Тефлон хорошо прилегает к зеркальному стеклу, а нижние торцы боковых прокладок можно слегка смазать силиконовым маслом. Прокладки между стеклами надежно зажимают по всей периферии пружинными зажимами для бумаг. (На рисунке показаны только 4 зажима с одной стороны пластины.) Вся камера таким образом должна быть надежно герметизирована, кроме верхнего ее края, на то время, пока в ней будет проходить полимеризация жидкой смеси предшественников ПААГ.
По окончании этого процесса (о чем можно судить по образованию резкой границы между гелем и тонким слоем воды, которым защищают полимеризацию от контакта с кислородом воздуха) зажимы можно снять. Полимеризация занимает обычно 30-40 минут.
В аналитических опытах на каждой пластине в параллельных «треках» ведут электрофорез нескольких препаратов, состав которых затем можно сопоставлять при строго одинаковых условиях разделения (рис.2 ).

Рис2.
Для фиксации этих треков в ходе полимеризации на верхнем крае геля формируют ряд одинаковых углублений прямоугольной формы «карманов», куда затем и вносят различные препараты.
Для этого в еще не заполимеризовавшийся гель вставляют «гребенку» из тефлона, такой же толщины, как прокладки между стеклами. Как видно на разрезе, верхняя часть гребенки делается немного толще, чем нижняя (с зубцами). Это удобно так как позволяет устанавливать гребенку каждый раз одинаково и ровно — до упора в торец стеклянной пластины. Жидкий гель заливают между пластинами с таким расчетом, чтобы при опускании гребенки до упора он заполнял бы промежутки между ее зубцами. Торцы зубцов гребенки перед установкой смачивают, потерев их об стекло с налитым на него жидким гелем. Кроме того начинают вставлять ее с некоторым перекосом, следя за тем, чтобы под зубцами не задержались пузырьки воздуха.
После завершения полимеризации геля снимают зажимы, удаляют нижнюю прокладку и вынимают гребенку. Весь «сэндвич» сохраняет свою целостность благодаря прилипанию ПААГ к стеклу. Его устанавливают в простой прибор, склеенный из оргстекла — его нетрудно изготовить в лабораторных условиях (рис. 3). Так, чтобы то стекло формы геля, которое имеет вырез, прилегало к верхнему резервуару прибора. Вырезы в стекле и резервуаре совпадают, а второе, не вырезанное стекло формы геля, замыкает собой объем резервуара.
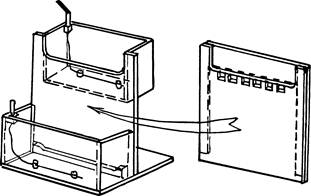
Рис. 3
Его можно заполнять буфером, который таким образом попадает и в карманы геля. Естественно, что всю форму с гелем надо хорошо прижать к стенке прибора (лучше через резиновую прокладку), чтобы предотвратить вытекание буфера из верхнего резервуара. На дне коробки нижнего резервуара видна опора, на которую ставят пластины с гелем. Выемка на этой опоре обеспечивает контакт нижнего буфера с нижним торцом геля. Необходимо проверять, что на этом торце тоже нет пузырьков воздуха.
Препараты белков с добавленной в них сахарозой или глицерином вносят в карманы геля после окончания сборки прибора, осторожно подслаивая их, как было описано выше, под буфер. Препараты должны быть заведомо освобождены от пыли, нерастворившихся белков и других посторонних частиц фильтрованием или центрифугированием.
В верхнем и нижнем резервуарах для буфера видны проволочки электродов. Через штырьковые разъемы их присоединяют к клеммам источника питания.
В приборе описанного типа можно обойтись и без вырезов в стеклянной пластине и верхнем резервуаре, если электрическую цепь между верхним буфером и гелем замкнуть через смоченный тем же буфером широкий фитиль из толстой фильтровальной бумаги. Конструкция прибора упрощается, но при этом следует иметь в виду возможность обсыхания фитиля, что приведет к увеличению его электрического сопротивления, а следовательно к уменьшению напряжения, подающегося на гель.
По окончании электрофореза пластины разнимают, отслаивая одну из них от геля с помощью шпателя. Его всовывают между пластинами со стороны карманов и слегка поворачивают. Эту операцию не следует форсировать. Лучше сначала пройтись шпателем с легким нажимом вдоль всего верхнего края пластины, наблюдая за тем как между стеклом и гелем постепенно проникает воздух, а потом уже приподнять пластину. Со второй пластины гель снимают руками и переносят в ванночку для фиксации белков и их окраски. Эту простую операцию следует производить в перчатках. Случайное прикосновение руки к рабочей поверхности геля при современных высокочувствительных методах окрашивания может оставить на геле артефактное белковое пятно.
Я намеренно столь подробно описал операцию проведения электрофореза в этом простом устройстве, чтобы дать учащемуся или читателю представление о необходимости исключительной предусмотрительности и тщательности в постановке соответствующих экспериментов.
Похожие работы
... то их нередко удается разделить полностью — они выходят в виде довольно широких, но не перекрывающихся друг с другом пиков. Если же смесь состоит из нескольких компонентов, то на хорошее их разделение методом гель-фильтрации рассчитывать не приходится. Ведь все эти компоненты, хотя и с различной скоростью, движутся по колонке одновременно. (Другое дело истинная хроматография. Там на первый план ...
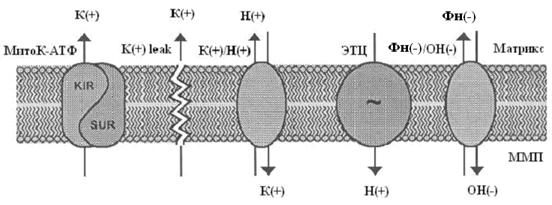
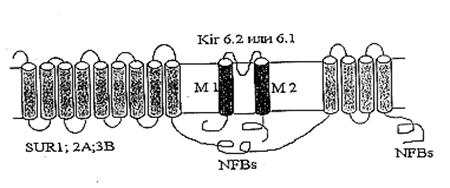
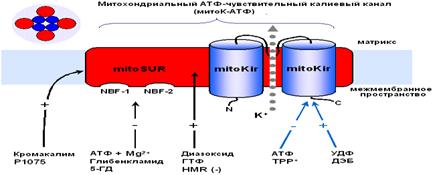
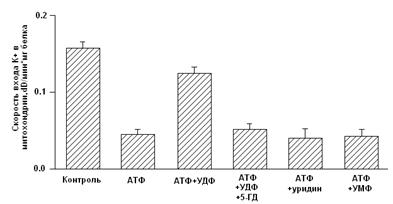
... м, в течение 10-15 мин. Группа низкоустойчивых (НУ) животных выдерживала эту высоту только в течение 1-1.5 мин. Глава 5. Результаты и обсуждения 5.1 Параметры функционирования митоКАТФ канала у крыс с различной резистентностью, а также у животных, адаптированных к гипоксии В этом разделе работы исследовались такие показатели, как дыхание МХ, скорость АТФ-зависимого К+ транспорта, ...
... а его введение животным, подвергнутым острому воздействию глутамата, приводит к активации протеиназ, отвечающих за аутофагию (лизосомальных катепсинов), и к восстановлению физиологического уровня активности кальпаиновой системы в мозге крыс, а также к улучшению других биохимических и поведенческих показателей у экспериментальных животных. Воздействие эстрадиола оказалось положительным при разных ...
... особенностей взаимного варьирования содержания белковых фракций в анализируемых образцах нами был проведен многомерный количественного содержания белков эритроцитарных мембран человека. Была построена матрица фенотипических корреляций количественного содержания гемоглобина и основных белков мембран эритроцитов. Данная матрица представлена в таблице 2. Из нее видно, что полученные коэффициенты ...


0 комментариев