Навигация
Иммуноанализ методом подсчета частиц
Иммуноанализ методом подсчета частиц
ВВЕДЕНИЕ
Агглютинационные свойства антител известны уже давно. По сути дела, именно способность антител вызывать агглютинацию и привела к открытию и идентификации антител. В середине 50-х годов эти свойства антител были впервые использованы Сингером и Плотцом при создании иммуноанализа с латексной агглютинацией. За прошедшие годы этот метод интенсивно развивался и совершенствовался. Хотя значительная часть исследований была направлена на развитие количественного анализа, до последнего времени основные достижения иммуноанализа с латексной агглютинацией ограничивались разработкой методик качественного анализа, прежде всего для контроля беременности и в серологии. Развитие исследований сдерживалось из-за влияния белков сыворотки на результаты анализа и в связи с недостаточной чувствительностью метода.
В конце 70-х годов Массой и др. впервые описали ряд способов и приемов, позволяющих: 1) повысить чувствительность анализа, 2) устранить специфические и неспецифические побочные эффекты, мешающие ходу анализа, 3) расширить диапазон применения.
Совершенствование, сочетание и расширение этих способов и приемов позволили создать систему гомогенного анализа - имму-ноанализ методом подсчета частиц. Эта глава посвящена описанию системы IMPACT и обсуждению основных направлений ее дальнейшего развития.
1. ПРИНЦИПЫ АНАЛИЗА
Основной принцип системы IMPACT очень прост: иммуноанализ с латексной агглютинацией выполняется с помощью полностью автоматизированного комплекса, осуществляющего все операции и обработку данных. После инкубации реакционная смесь разбавляется и затем пропускается через проточную кювету оптического счетчика частиц. Счетчик подсчитывает только неагглютинированные частицы, а компьютер с помощью полученных данных строит калибровочную кривую и находит концентрацию определяемого вещества в клинических пробах.
Коллимированный луч света, сфокусированный до диаметра 7,5 мкм, проходит через проточную кювету и попадает на черное пятно. Если свет встречает на своем пути частицы, то последние рассеивают свет так, что он проходит мимо пятна и попадает на коллектор. Интенсивность света измеряется фотоумножителем, выход которого подключен к простому анализатору высоты импульса. Импульсы, соответствующие отдельным частицам, подсчитываются и анализируются. Импульсы от фонового шума или полимерных частиц не учитываются.
Антигены количественно определяют путем смешивания пробы сыворотки, плазмы, цереброспинальной жидкости или мочи с суспендированными в буфере латексными частицами диаметром 0,8 мкм, на которые нанесены антитела. Антигены из пробы агглютинируют некоторые такие частицы, снижая тем самым число оставшихся частиц.. Следовательно, концентрация антигена должна быть обратно пропорциональной числу неагтлюти-нированных частиц.
Аналогично определяют антитела, способные агглютинировать латексные частицы, на которые нанесены антигены. Агглютинирующую активность антител иммуноглобулина G можно усилить ревматоидным фактором IgM. RF выгодно отличается от антисыворотки против иммуноглобулинов тем, что не требует операции промывки для удаления несвязанных иммуноглобулинов. Неспособность некоторых антигенов, например фосфолипазы А2 - аллергена пчелиного яда и антигена вируса Herpes simplex, к солюбилизации может привести к неспецифическому связыванию иммуноглобулинов. Этот источник ошибок можно устранить с помощью частиц латекса, на которые нанесены антитела. Такие частицы агглютинируют в присутствии антигена. Тогда изучаемые антитела можно определять титрованием, воспользовавшись их способностью ингибировать агглютинацию.
Иммунные комплексы (рис.1) определяют по агглютинирующей активности RF или мышиных Clq по отношению к латексным частицам, покрытым IgG. Иммунные комплексы, связывающие агглютинмрующий агент, уменьшают степень агглютинации латекса. Следовательно, концентрация иммунных комплексов пропорциональна концентрации неагглютинированнык частиц (рис.2).
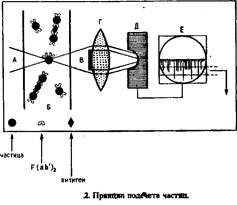
Гаптены определяют с помощью частиц латекса, на teoroptte нанесены молекулы гаптена и антител IgG против гаптена (рис.3). Образующийся комплекс агглютинирует присутствии RF человека.
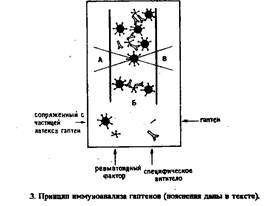

Если в пробе содержится свободный гаптен, он конкурирует с конъюгатом гаптен-латекс за центры связывания антител IgG и поэтому ингибирует агглютинацию, что приводит к увеличению числа неагглютинированных частиц. Концентрация гап-тена пропорциональна числу неагглютинированных частиц.
2. УСТРАНЕНИЕ ПОБОЧНЫХ ЭФФЕКТОВ СЫВОРОТКИ
Агглютинации могут мешать многие факторы. Они обычно приводят к нежелательной самоагглютинации, степень которой изменяется от пробы к пробе. Для устранения соответствующих эффектов разработан ряд методик, ив конкретных анализах веществ одна или несколько таких методик обычно обязательны.
Неспецифические эффекты могут быть обусловлены неустойчивостью любых латексных суспензий, даже если на поверхность частиц не нанесено никаких веществ. Эти эффекты снижаются при тщательном подборе буферных растворов, связываемых с частицами белков, и характеристик частиц, в том числе полярности и' плотности поверхностного заряда. Ионная сила буферных растворов должна обеспечивать примерно нейтральный результирующий поверхностный заряд.

Антитела или конъюгаты гаптенов с белками связываются с частицами ковалентно, а оставшиеся незанятые участки поверхности частиц затем насыщаются балластными белками для уменьшения гидрофобного взаимодействия между частицами.
Специфические эффекты, обусловленные наличием RF или Clq в пробах сыворотки или антиидиотипических антител в поликлональных антисыворотках, можно устранить различными приемами. Соответствующие примеры представлены на рис. 4 и 5. Схема последовательного устранения различных эффектов в случае пробы неопределенного состава при определении ферритина представлена на рис. 4. Известен ряд операций, позволяющих упростить методики. Во многих случаях, например при определении тироксина, трииодтиронина, поверхностного антигена гепатита В, ^иммуноглобулина Е и го-надотропина человека, предварительная обработка пробы пепсином устраняет побочные эффекты сыворотки, не разрушая определяемое вещество или превращая его в соединения, сохраняющие иммунологическую активность. На рис. 5 в качестве примера представлена схема определения тиротропина, в которой для устранения влияния белков сыворотки на результаты анализа применен этот подход.
Для повышения скорости реакции все анализы проводят при 37°С в термостате с перемешиванием. Реакцию осуществляют в пробирках 12 х 55 мм, вращающихся со скоростью 1550 об/мин с отклонением от оси вращения на 2,00 мм. Такое перемешивание обеспечивает необходимую частоту столкновений и ориентацию комплексов частиц с определяемым веществом по отношению к не-прореагировавшим частицам, в результате чего образуются термодинамически более устойчивые ассоциаты. При использовании по-ликлональной антисыворотки такое перемешивание может повысить специфичность антител путем разрушения неустойчивых ас-социатов, образующихся в результате перекрестных реакций.
Похожие работы
... результат можно получить через 1-2 часа после начала исследования при концентрации вибрионов не менее 106 клеток в 1 мл., поэтому рекомендуется предварительно подращивание материала на питательных средах. Экспресс-диагностика туляремии Возбудитель туляремии (Туляре - район Калифорнии) - Franciella tularensis относится к роду с невыясненным положением в систематике микробов. Этиологическая природа ...
0 комментариев