МІНІСТЕРСТВО ОХОРОНИ ЗДОРОВ’Я УКРАЇНИ
ДОНЕЦЬКИЙ НАЦІОНАЛЬНИЙ МЕДИЧНИЙ УНІВЕРСИТЕТ
ІМ. М. ГОРЬКОГО
УДК 616.33+616.34+616.33-002+616-092
ЗНАЧЕННЯ МІСЦЕВИХ НЕСПЕЦИФІЧНИХ ПРОТЕОЛІТИЧНИХ МЕХАНІЗМІВ У РОЗВИТКУ ВИРАЗКОВИХ УРАЖЕНЬ ШЛУНКОВО-КИШКОВОГО ТРАКТУ
14.03.04 - патологічна фізіологія
Автореферат
дисертації на здобуття наукового ступеня
кандидата медичних наук
Донецьк - 2008
Дисертацією є рукопис.
Робота виконана в Кримському державному медичному університеті ім. С. І. Георгієвського МОЗ України (м. Сімферополь)
Науковий керівник: доктор медичних наук, професор
Кубишкін Анатолій Володимирович,
Кримський державний медичний університет
ім. С. І. Георгієвського МОЗ України,
професор кафедри патологічної фізіології.
Офіційні опоненти: доктор медичних наук, професор
Казімірко Ніла Казімірівна,
Луганський державний медичний університет
МОЗ України, завідувач кафедри патологічної фізіології.
доктор медичних наук, професор
Гоженко Анатолій Іванович,
Одеський державний медичний університет
МОЗ України, завідувач кафедри
загальної та клінічної патологічної фізіології.
Захист відбудеться “20” червня 2008 р. о 1000 годині на засіданні спеціалізованої вченої ради Д 11.600.02 при Донецькому національному медичному університеті ім. М. Горького МОЗ України (83003, Україна, м. Донецьк, пр. Ілліча, 16).
З дисертацією можна ознайомитися в бібліотеці Донецького національного медичного університету ім. М. Горького (83003, Україна, м. Донецьк, пр. Ілліча, 16).
Автореферат розісланий “14” травня 2008 р.
Вчений секретар
спеціалізованої вченої ради Д 11.600.02,
доктор медичних наук,
доцент М. В. ЄРМОЛАЄВА
ЗАГАЛЬНА ХАРАКТЕРИСТИКА РОБОТИ
Актуальність теми. ВХШ й ВХДПК залишається актуальною проблемою гастроентерології, оскільки в структурі захворюваності займає одне з перших місць і приводить до зниження працездатності й інвалідності хворих. Незважаючи на широкий арсенал сучасних діагностичних і лікарських засобів, які застосовуються для діагностики й лікування виразкової хвороби, відзначається висока частота розвитку ускладнень, що сполучаються зі схильністю до розвитку рецидивів захворювання й резистентністю до проведеної терапії (Склянська О.А., 2004) Незважаючи на загальновизнану провідну роль інфікування Helicobacter pylori в ульцерогенезі ВХШ й ВХДПК є складним багатофакторним за патогенезом гастроентерологічним захворюванням, а багато патогенетичних ланок ульцерогенезу залишаються дискутабельними й до кінця не вивченими (Аруин Л.И., 1998; Скрипник І.М., 2001; Ліпатнікова А.С., 2006).
Ключову роль в ульцерогенезі грають запальні зміни, які розвиваються в слизовій оболонці на втручання Helicobacter pylori і знижують її резистентність до впливу факторів пептичної агресії, сприяють утворенню виразки (Соловьева Г.А., 2007). У розвитку неспецифічного запалення приймають участь гуморальні і клітинні механізми, одним із ключових компонентів яких є нейтрофільні гранулоцити, що містять значну кількість лізосомальних протеїназ, які мають деструктивний потенціал (Pham C.T., 2006). Активація протеїназ визначає, у значній мірі, патогенез запального процесу, у тому числі в слизовій шлунка (Bergin P.J. et al., 2004), а їхня взаємодія із інгібіторами протеїназ визначає ступінь протеолітичної агресії в плані розвитку деструктивних змін в тканинах, що вони ушкоджують (Lindstedt K.A. et al., 2004). Розуміння ролі взаємодії компонентів протеїназ-інгібіторної системи служить важливою ланкою у з'ясуванні молекулярних основ патології (Веремеенко К.Н., 1994; Кубишкін А.В., 2008). Крім того, вивчення неспецифічних протеолітичних механізмів розвитку патології в системі травлення викликає інтерес у зв'язку з його насиченістю специфічними протеїназами, що беруть участь у процесах травлення.
Таким чином, складні й не до кінця вивчені механізми формування виразкових уражень системи травлення обґрунтовують необхідність удосконалювання діагностичних і лікувальних підходів на основі розкриття нових патогенетичних механізмів їхнього формування. Вивчення ролі місцевих неспецифічних протеолітичних механізмів у формуванні ульцерогенезу дозволить не тільки поліпшити якість діагностики, але й проводити адекватний прогноз і профілактику цих порушень із розробкою надалі підходів до вдосконалювання терапії.
Зв'язок роботи з науковими програмами, планами, темами. Робота виконана в рамках наукової тематики кафедри патологічної фізіології Кримського державного медичного університету ім. С. І. Георгієвського “Розробка підходів для оцінки патогенетичної ролі тканинних протеїназ й їх інгібіторів при системних і локальних патологічних процесах” (номер держ. реєстрації 0107U001255). Дисертант є співвиконавцем теми.
Мета дослідження. Установити значення місцевих неспецифічних протеолітичних механізмів у розвитку виразкових уражень травного тракту і розробити критерії діагностики й прогнозу розвитку.
Завдання дослідження:
1. Вивчити стан протеїназ-інгібіторної системи слизової оболонки шлунка й слизової оболонки кишечнику при експериментальному моделюванні виразкових ушкоджень травного тракту.
2. Зіставити стан компонентів протеїназ-інгібіторної системи й ультраструктурні зміни тканини шлунка при експериментальному моделюванні виразково-некротичних ушкоджень слизової оболонки гастродуоденальної зони.
3. Визначити характер змін активності неспецифічних протеїназ шлункового соку у хворих з захворюваннями травного тракту.
4. Дослідити стан показників місцевого антипротеїназного захисту слизової оболонки гастродуоденальної зони у хворих з патологією шлунка й дванадцятипалої кишки.
5. Виявити діагностичне й прогностичне значення змін еластазоподібної активності шлункового соку для оцінки ступеня ушкодження слизової оболонки шлунка й слизової оболонки кишечника.
Об'єкт дослідження: експериментальні тварини з моделлю виразкової хвороби й хворі різних вікових груп з патологією гастродуоденальної зони.
Предмет дослідження: значення системи місцевих неспецифічних протеолітичних й антипротеолітичних механізмів у формуванні виразково-некротичних уражень травного тракту.
Методи дослідження – біохімічні, морфологічні і статистичні.
Наукова новизна отриманих результатів. У результаті комплексного вивчення процесів протеолізу шлункового змиву, супернатанту стравохідного відділу слизової оболонки шлунка, супернатанту фундального відділу слизової оболонки шлунка, кишкового змиву й супернатанту слизової оболонки тонкої кишки і сироватки крові в експериментальних тварин, шлункового соку у хворих різних вікових груп з гастродуоденальною патологією, а також морфологічних змін у стінці шлунка й тонкого кишечнику виявлені нові патогенетичні аспекти розвитку ВХШ й ВХДПК. Уперше установлено, що дисбаланс у протеїназ-інгібіторній системі може бути одним з факторів, який приводить до формування ВХШ й ВХДПК. Уперше встановлено, що механізми ушкодження слизової оболонки шлунка й слизової оболонки дванадцятипалої кишки безпосередньо взаємозалежні з порушеннями в протеїназ-інгібіторній системі. Виявлено регіональні особливості в стані інгібіторів протеїназ у різних відділах системи травлення. Показано, що фактором, який приводить до ушкодження слизової оболонки служить пригнічення місцевих неспецифічних протеїназ потенціалу при збільшенні активності неспецифічних протеїназ, у першу чергу еластазоподібної активності. Розроблений принципово новий підхід для вдосконалення діагностики ступеня ушкодження слизової оболонки шлунка й дванадцятипалої кишки у хворих з патологією гастродуоденальної зони.
Практичне значення отриманих результатів. Отримані в ході досліджень дані розширюють уявлення про патогенез ВХШ й ВХДПК. Показано доцільність визначення показників протеїназ-інгібіторної системи при захворюваннях гастродуоденальної зони. При оцінці ступеня ушкодження слизової оболонки гастродуоденальної зони варто проводити дослідження стану протеїназ-інгібіторної системи шлункового соку. Для визначення ступеня ефективності проведеної терапії на госпітальному етапі варто враховувати динаміку показників активності місцевого неспецифічного протеїназ-інгібіторного потенціалу шлункового соку. Зниження або збереження низького рівня інгібіторів протеїназ при високій активності неспецифічних протеїназ варто вважати несприятливою ознакою, що впливає на прогноз.
Матеріали роботи використані в навчальному процесі кафедр патофізіології Кримського державного медичного університету ім. С. І. Георгієвського, Харківського національного медичного університету, Тернопільського державного медичного університету ім. І. Я. Горбачевського, Донецького національного медичного університету ім. М. Горького, Медичного інституту Сумського державного університету.
Особистий внесок здобувача. Автором було проведенио патентно-інформаційний пошук, аналіз актуальності і ступеня вивчення проблеми; визначені напрямки досліджень, сформульовано ціль і задачі роботи, проведено огляд і аналіз літератури, визначено методологічні підходи, відпрацьовано експериментальні моделі, вивчено та узагальнені результати проведених досліджень, обґрунтовано наукові висновки. Розроблено спосіб оцінки стану слизової оболонки шлунка у хворих з гастродуоденальною патологією (деклар. патент України на корисну модель № 26332 (А61У 10/00) від 10.09.2007 р.
Апробація результатів. Апробовані на спільному засіданні кафедр патологічної фізіології, гістології, цитології та ембріології, нормальної фізіології, патологічної анатомії, терапії і сімейної медицини ФПО Кримського державного медичного університету ім. С. І. Георгієвського МОЗ України, протокол № 68, від 15.01.2008 р). Результати досліджень повідомлені на: науково-практичній конференції “Актуальні питання патофізіології” (Ялта, 2006 р.), Міжнародної конференції молодих вчених “Актуальні проблеми клінічної, експериментальної та профілактичної медицини” (Донецьк, 2007 р.); VI-тих читаннях В. В. Підвисоцького (Одеса, 2007 р.), засіданні товариства патофізіологів Криму (Сімферополь, січень 2008 р.).
Публікації. За матеріалами дисертації опубліковано 8 праць, із них 5 – статті в ліцензованих ВАК України журналах і збірниках, 3 з котрих – моноавторські, 2 – у матеріалах, наукових конференцій. Отримано 1 деклараційний патент України на корисну модель.
Обсяг і структура дисертації. Дисертаційна робота складається із вступу, огляду літератури, матеріалів і методів дослідження, розділу власних досліджень, аналізу та узагальнення результатів, висновків, практичних рекомендацій, списку використаних джерел. Бібліографічний перелік містить 280 найменувань, із них 167 кирилицею та 113 латиницею. Текст викладено на 112 сторінках тексту, ілюстровано 14 таблицями, 7 графіками, 9 світловими і 12 електронними мікрофотографіями, 10 рисунками.
ОСНОВНИЙ ЗМІСТ РОБОТИ
Матеріал і методи дослідження. Експериментальні дослідження проведені на 24 білих щурах-самцях лінії “Vistar”, масою тіла 180-200 г. Утримання тварин у віварії було однаковим, що є необхідною умовою створення структурної групи. Температура приміщення, де здійснювалися експерименти, складала 19-22 °С. Експериментальні дослідження проводилися відповідно до вимог “Європейської конвенції про захист хребетних тварин, які використовуються в дослідницьких та інших наукових цілях” (Strasburg, 18.03.1986 р.). Експерименти проводилися згідно дозволу Вченої Ради Кримського медичного інституту (протокол № 103 від 30.11.1977 р.); комісії з питань біоетики при Кримському державному медичному університеті ім. С. І. Георгієвського (протокол № 11 від 08.01.2008 р.). Гостру виразку шлунка моделювали двома способами. Перший - шляхом підшкірного введення тваринам індометацину в дозі 35 мг/кг маси тіла після 24 годин голодування. Декапитацію проводили через 4 години після введення індометацину - індометацинова виразка. Другий - імобілізацією тварин, які напередодні голодували протягом 24 годин, у тісних клітках-пеналах у положенні на животі протягом 6 годин при температурі 8 оC - стресова виразка.
Клінічні дослідження проводилися на 165 пацієнтах з різноманітною патологією гастродуоденальної зони з яких 42 дорослих пацієнта і 123 дітей. Фіброгастродуоденоскопічне дослідження верхніх відділів травного тракту проводили з використанням гнучкого ендоскопу японської фірми “Olympus”. У результаті дослідження були виявлені різноманітні зміни слизової оболонки шлунка від ознак поверхневого запалення до ерозивних форм у дітей і до виразок у дорослих. Для опису змін слизової оболонки у хворих на гастрит використали “Класифікацію і градацію гастриту. Модифіковану Сіднейську систему” (1996).
ТПА біологічного матеріалу вимірювали спектрофотометричним методом (А. В. Кринська та співавт., 1977). Вимір ЕПА біологічного матеріалу проводили за гідролізом синтетичного субстрату N – t – BOC – аланіл – p – нітрофенілового ефіру (Reanal) (О. Г. Оглоблина та співавт., 1980). Визначення АТА шлункового соку проводили за здатністю шлункового соку гальмувати гідроліз бензоіларгінін-р-нітроанілін трипсином. Для визначення КСІ у пробах попередньо осаджували кислотостабільні білки (В. Ф. Нартикова та співавт., 1969; О. Г. Оглоблина та співавт., 1980).
Морфологічні дослідження (світлову і електронну мікроскопію) шлунка і кишечнику проводили у експериментальних тварин. Діагностику Helicobacter pylori - інфекції проводили за уреазним експрес-методом, який базується на високій уреазній активності Helicobacter pylori. Біоптати, узяті з найбільш запальних ділянок слизової оболонки, поміщали в тест-розчин відразу після проведення гастроскопії. Результати оцінювали протягом першої години, наступної другої години й через 24 години за зміною забарвлення тест-розчину з жовтого на малиново-червоний, що свідчить про наявність Helicobacter pylori у досліджуваному шматочку слизової оболонки шлунка. Результати дослідження оцінювалися як “позитивні”, якщо забарвлення з'являлося протягом першої години, “слабопозитивні”, якщо зміна забарвлення наступала протягом другої години й “негативні”, якщо зміни забарвлення не наступало через 24 години.
Статистична обробка отриманих цифрових даних проведена з використанням методів варіаційної статистики з обчисленням середніх величин (M) і оцінкою ймовірності розбіжностей (m), вірогідними вважали показники при р<0,05. Статистичні розрахунки виконували з використанням електронних таблиць Exel для Microsoft Office.
Результати власних досліджень та їх обговорення. Експериментальним дослідженням місцевого неспецифічного протеїназ-інгібіторного потенціалу шлунка у інтактних тварин вперше були визначенні наступні рівні місцевих неспецифічних протеїназ та їх інгібіторів у шлунковому змиві ЕПА = 35,34 ± 6,84 нМ/мг•хв, ТПА = 28,92 ± 5,08 нМ/мг•хв, КСІ = 9,16 ± 2,26 мІО/мг; супернатанті стравохідного відділу слизової оболонки шлунка ЕПА = 30,69 ± 4,11 нМ/мг•хв, ТПА = 5,42 ± 1,28 нМ/мг•хв, КСІ = 16,70 ± 5,53 мІО/мг; супернатанті фундального відділу слизової оболонки шлунка ЕПА = 99,75 ± 13,74 нМ/мг•хв, ТПА = 25,29 ± 5,19 нМ/мг•хв, КСІ = 21,01 ± 2,66 мІО/мг; змиві тонкої кишки ЕПА = 102,76±7,01 нМ/мг•хв , ТПА = 25,26±5,74 нМ/мг•хв, КСІ = 13,91±3,67 мІО/мг; супернатанті слизової оболонки тонкої кишки ЕПА = 175,45 ± 18,09 нМ/мг•хв, ТПА = 29,15 ± 8,73 нМ/мг•хв, КСІ = 27,55 ± 4,10 мІО/мг. У сироватці крові ЕПА = 1,07 ± 0,19 мМ/мл•хв, ТПА = 278,0 ± 24,16 мМ/мл•хв, КСІ = 5,91 ± 0,36 мІО/мл.
Експериментальні дослідження в сироватці крові показали збільшення ТПА на 53,7 % (р<0,001) при індометациновій виразці. При моделюванні стресової виразки спостерігалося зниження ТПА на 34,6 % (р<0,001) у порівнянні з контролем. ЕПА сироватки крові перевищила контроль на 46,6 % і на 10,9 % при індометациновій і при стресовій виразках відповідно. Рівень активності КСІ в сироватці крові при індометациновій виразці, збільшився в порівнянні з контролем на 43 % (р<0,001). При моделюванні стресової виразки КСІ наближалася до контрольних значень. Проведені дослідження шлункового змиву показали ріст ТПА на 109 % (р<0,001) при індометациновій виразці, при стресовій на 272,7 % (р<0,05) у порівнянні з контролем. При індометациновій виразці спостерігалося зниження ЕПА шлункового змиву на 20,1 % у порівнянні з контролем, а стресова виразка викликала її збільшення у 3 рази (р<0,05). Активність КСІ знизилася щодо контролю при індометациновій виразці на 50 % (р<0,05), а при стресовій на 33 %. Ріст ТПА, спостерігався в супернатанті стравохідного відділу слизової оболонки шлунка, ТПА при цьому збільшилася стосовно контролю на 60,8 % при моделюванні індометацинової виразки (рис. 1). На моделі стресової виразки ТПА супернатанту стравохідного відділу слизової оболонки шлунка перевищила контроль майже у 2,5 рази. ЕПА у супернатанті стравохідного відділу слизової оболонки шлунка перевищила контроль на 158,6 % і на 101,9 % (р<0,001) при індометациновій і при стресовій виразках відповідно. Рівень КСІ у супернатанті стравохідного відділу слизової оболонки шлунка знизився в порівнянні з контролем при індометациновій виразці на 87 % (р<0,01), при стресовій на 62 % (р<0,05).
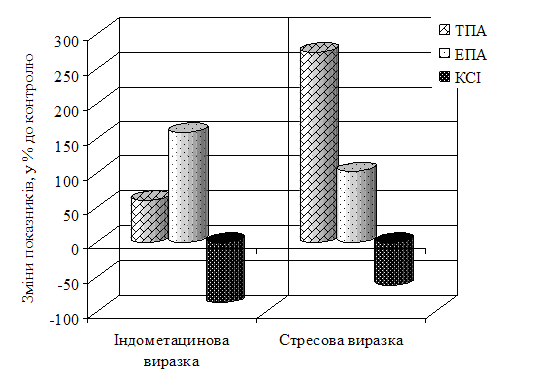
Рис. 1. Показники системи протеолізу супернатанту стравохідного відділу слизової оболонки шлунка щурів.
Дослідження в супернатанті фундального відділу слизової оболонки шлунка показало зниження ТПА на 33,8 % при індометациновій виразці, а при стресовій виразці - на 48,7 % (р<0,05) відносно контролю. Проведені дослідження показали збільшення ЕПА в порівнянні з контрольною групою на 45,6 % (р<0,05) при індометациновій виразці і на 54,1 % (р<0,001) при моделюванні стресової виразки. Активність КСІ супернатанту фундального відділу слизової оболонки шлунка при індометациновій виразці знизилася на 78 % (р<0,001) стосовно контролю, а при стресовій виразці на 32 % (р<0,05).
При індометациновій виразці у кишковому змиві відзначався ріст ТПА на 133,9 % (р<0,01) у порівнянні з контрольною групою. При стресовій виразці мало місце зниження активності ТПА кишкового змиву в порівнянні з контролем на 28,8 %. ЕПА при індометациновій виразці в кишковому змиві збільшилось на 43,2 % (р<0,01) у порівнянні з контрольною групою, а при стресовій - на 14,2 %. Відбувалося зниження рівня КСІ кишкового змиву на 60 % і на 34% при індометациновій і стресовій виразках відповідно у порівнянні з контролем. У супернатанті слизової оболонки тонкої кишки ТПА збільшилася в порівнянні з контролем на 45 % при індометациновій виразці, а при стресовій на 48,5 %. При індометациновій виразці спостерігалося збільшення ЕПА в супернатанті слизової оболонки тонкої кишки на 52,2 % (р<0,01) у порівнянні з контролем, а при стресовій на 35,4 % (р<0,01). Рівень КСІ знизився на 32 % (р<0,05) у супернатанті слизової оболонки тонкої кишки у порівнянні з контролем при стресовій виразці і на 78 % (р<0,001) при індометациновім.
При моделюванні індометацинової і стресової виразок спостерігається активація місцевих неспецифічних протеїназ - ТПА і ЕПА і зниження активності КСІ, що вказує на участь неспецифічних протеїназ й їхніх інгібіторів у механізмах деструкції слизової оболонки гастродуоденальної зони й свідчить про патогенетичну значимість їх активації при даній патології.
Описана нами динаміка змін біохімічних показників при моделюванні гострої виразки шлунка супроводжувалася специфічними змінами структури його слизової оболонки. При огляді у світловому мікроскопі у щурів, яким моделювали індометацинову і стресову виразки розвивався набряк слизової оболонки шлунку з виразками, з ознаками кровотечі і множинними ерозіями шлунка, найбільш виразними у фундальному відділі шлунка. У щурів, яким моделювали стресову виразку, морфологічні зміни носили менш виразний дистрофічний і деструктивний характер, при цьому зміни в стані протеїназ-інгібіторного балансу також були менш виразні.
Електронно-мікроскопічне дослідження виразок виявило порушення нормальної структури епітеліального шару, з хаотично розташованими клітинами однорядного залозистого призматичного епітелію, між якими виявлялися поодинокі клітини запального ряду й елементи клітин власних залоз шлунка. У ділянках з виразковими дефектами спостерігалася лейкоцитарна інфільтрація. У індометациновій виразці лейкоцити знаходились серед клітинного детриту й були оточені деструктивно некротизованими екзокриноцитами або їх відламками. При індометациновій виразці в деяких екзокриноцитах мають місце деструктивні зміни комплексу внутрішньоклітинних органел із формуванням вакуолеподібних утворень з дрібними секреторними гранулами. Змінюється також структура парієтальних екзокриноцитів. Очевидно, порушення структури й функції секреторних клітин може позначатися й на секреції інгібіторів, які синтезуються місцево, привести до виснаження й зниження антипротеазного потенціалу.
Клінічні дослідження шлункового соку дітей з патологією гастродуоденальної зони показали, що в шлунковому соці групи дітей з функціональними захворюваннями шлунка, які склали контрольну групу, мали місце наступні рівні неспецифічних протеїназ і їх інгібіторів: ЕПА = 0,72±0,04 нМ/мг• хв, ТПА = 0,63±0,03 нМ/мг• хв, АТА = 57±0,02 мІО/мг.
У групі дітей з поверхневим гастритом і гастродуоденітом рівень ТПА знижувався на 12,7 %, ЕПА збільшувалась на 9,1 % (р<0,05) у порівнянні з контрольною групою. При цьому АТА шлункового соку у пацієнтів цієї групи хворих практично не відрізнялася від контролю (рис. 2). У групі хворих дітей з гіпертрофічним гастритом спостерігався ріст ТПА на 39,7 % (р<0,001), а ЕПА в 44 рази (р<0,001) у порівнянні з контрольною групою. АТА шлункового соку у даній групі хворих знижувалася на 43,6 % (р<0,001) у порівнянні з контролем. Дослідження в групі хворих дітей з ерозивним гастритом показали ріст трипсиноподібної активності шлункового соку на 82,5 % (р<0,001), еластазоподібної активності в 50 разів (р<0,001) у порівнянні з пацієнтами групи контролю, що, імовірно, указує на виразний ступінь важкості запального процесу слизової оболонки шлунку з наявністю деструктивного компоненту. У хворих даної групи у порівнянні з показниками контрольної групи, виявлене зниження антитриптичної активності шлункового соку на 57,8 % (р<0,001). Дослідження потенціалу інгібіторів шлункового соку у цієї групи хворих показало виснаження захисних можливостей слизової оболонки шлунка. Усе вище сказане свідчить про виразні порушення в місцевій протеїназ-інгібіторній системі у хворих з ерозивним гастритом, що потребує необхідності ретельного лікування й спостереження за даною групою хворих.
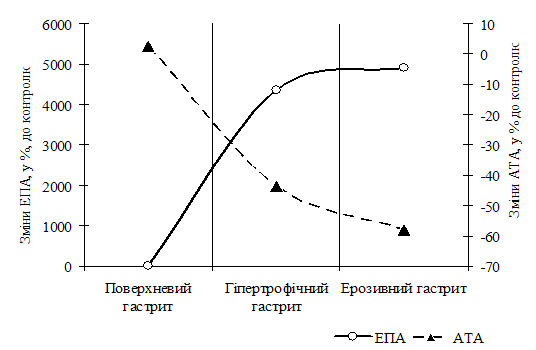
Рис. 2. Показники еластазоподібної і антитриптичної активності шлункового соку дітей.
Таким чином, рівень активації місцевих неспецифічних протеїназ й їхніх інгібіторів свідчить про ступінь важкості запального процесу, що протікає в слизовій оболонці шлунка й слизовій оболонці дванадцятипалої кишки. Підвищення ЕПА, як правило, є більш виразним в порівнянні із ТПА, що вказує на участь неспецифічних протеїназ у механізмах деструкції слизової оболонки шлунка й свідчить про патогенетичну значимість їх активації при даній патології.
Стан місцевої неспецифічної протеїназ-інгібіторної системи шлункового соку у дорослих у контрольній групі, яку склали пацієнти, яким була проведена фіброгастродуоденоскопія, але патологічних змін слизової оболонки шлунка й слизової оболонки дванадцятипалої кишки не було виявлено: ЕПА = 33,39 ±2,49нМ/мг• хв, ТПА = 14,58±1,12нМ/мг• хв, КСІ = 52,24±2,05мІО/мг.
У групі хворих з поверхневим гастритом рівень ТПА шлункового соку збільшився в порівнянні з контролем на 191,7 % (р<0,001), ЕПА - збільшилася на 48,6 % (р<0,05). Рівень КСІ шлункового соку знизився на 50,2 % (р<0,001) відносно контролю (рис. 3). Дослідження групи пацієнтів з ерозивним гастритом показали збільшення ТПА шлункового соку більше ніж у 2 рази (р<0,001) щодо контролю, а ЕПА на 128,2 % (р<0,001). Рівень активності КСІ знижувався на 61,5 % (р<0,001) відносно контрольних значень.
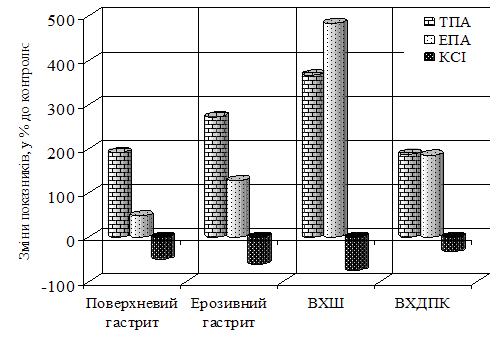
Рис. 3. Показники системи протеолізу шлункового соку дорослих.
У групі хворих з ВХШ ТПА шлункового соку збільшилася в порівнянні з контрольною групою більше, ніж у 3,5 рази. У даній групі виявлене збільшення ЕПА шлункового соку більше, ніж в 4 рази (р<0,001) у порівнянні з контрольною групою. Активність КСІ групи з виразковою хворобою шлунка знизилася на 75,1 % (р<0,001) у порівнянні з контролем. У групі хворих з ВХДПК рівень ТПА збільшився в порівнянні з контролем на 187,6 % (р<0,001), ЕПА - на 184,3 % (р<0,001). Активність КСІ шлункового соку в представленій групі хворих знижувалася на 32% (р<0,001) у порівнянні з показниками контрольної групи.
Таким чином, при посиленні ступеня виразності деструкції слизової оболонки шлунка збільшується рівень ТПА і ЕПА і, а рівень активності КСІ, які в нормі пригнічують ферментативну активність, виснажується. У пацієнтів при розвитку ВХДПК на тлі підвищеного рівня активності місцевих неспецифічних протеїназ відзначається компенсований стан потенціалу інгібіторів, при його визначенні у шлунковому соці. Можна припустити, що компенсований стан потенціалу інгібіторів у шлунку більше призводить до розвитку ВХДПК. Узагальнення даних експериментальних і клінічних досліджень вказує на існування певних закономірностей у зміні стану місцевої протеїназ-інгібіторної системи, які проявляються підвищенням активності місцевих неспецифічних протеїназ і зниженням активності їхніх інгібіторів, як у експериментальних тварин, так й у хворих різних клінічних груп при розвитку виразково-некротичних ушкоджень слизової оболонки гастродуоденальної зони. Очевидно, що зіставлення таких змін протеїназ-інгібіторної системи шлункового соку у хворих різних клінічних груп дозволяє зробити висновок, що перевага активності місцевих неспецифічних протеїназ над їх інгібіторами являється важливою ланкою патогенезу ВХШ й ВХДПК.
У науковій літературі описаний ряд класичних факторів, що мають вирішальне значення у розвитку деструктивних ушкоджень слизової оболонки гастродуоденальної зони (Соловьева Г.А., 2007). Проведені нами клініко-експериментальні дослідження дозволяють додати в цей ряд загальновизнаних патогенетичних ланок ульцерогенезу ще й порушення в місцевій неспецифічній протеїназ-інгібіторній системі з розвитком протеїназ-інгібіторного дисбалансу й запропонувати патогенетичну схему, що показує місце й значення порушень у системі протеолізу в патогенезі ВХШ (рис. 4).
Розвиток деструктивних ушкоджень слизової оболонки шлунка й слизової оболонки дванадцятипалої кишки супроводжується активацією місцевих неспецифічних протеолітичних ферментів і зниженням їх інгібіторів. Оцінка стану місцевого неспецифічного протеїназ-інгібіторного потенціалу має важливе диференційно-діагностичне значення для оцінки ступеня важкості запальних змін, судження про наявність деструктивного компоненту й з'ясування захисних можливостей слизової оболонки шлунка й слизової оболонки дванадцятипалої кишки, а також може стати одним із критеріїв ефективності проведеного лікування.
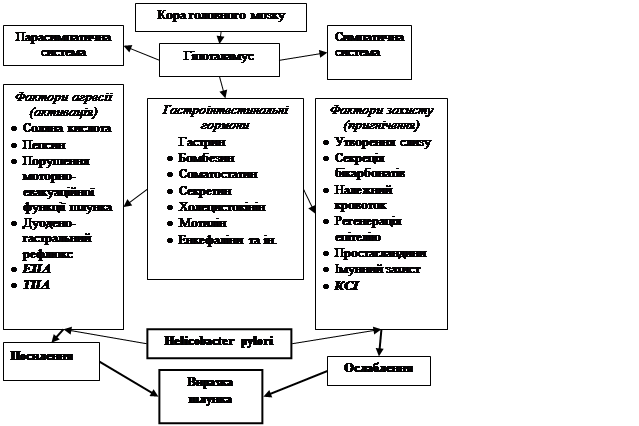
Рис. 4. Схема патогенезу виразкової хвороби шлунка зі включенням місця неспецифічних протеїназ та їх інгібіторів.
ВИСНОВКИ
У дисертаційній роботі приведені нові теоретичні узагальнення експериментальних і клінічних результатів дослідження й представлене нове розв'язання наукового завдання, що полягає у встановленні ролі змін місцевих неспецифічних протеїназ й їхніх інгібіторів у механізмах розвитку виразкових уражень шлунка й дванадцятипалої кишки. Наукова задача вирішена шляхом використання біохімічних і морфологічних методів дослідження.
1. Моделювання гострої виразки шлунка у щурів супроводжується активацією системи протеолізу, що проявляється збільшенням трипсиноподібних й еластазоподібних протеїназ та зниженням місцевого антипротеїназного потенціалу шлунка. Найбільше збільшення даних показників у порівнянні з контролем спостерігаються при індометациновій виразці в супернатанті стравохідного відділу слизової оболонки шлунка (ЕПА в 2,6 рази р<0,001, ТПА в 1,6 рази) і кишковому змиві (ЕПА на 43,2% р<0,01, ТПА в 2,3 рази р<0,01), а при стресовій – у шлунковому змиві (ЕПА в 3,9 рази р<0,05) і в супернатанті стравохідного відділу слизової оболонки шлунка (ЕПА в 2 рази р<0,001, ТПА в 3,7 рази), яке супроводжується зменшенням активності кислотостабільних інгібіторів у порівнянні з контролем у 7,3 рази (р<0,05) у супернатанті стравохідного відділу слизової оболонки шлунка й в 4,5 рази (р<0,05) у супернатанті слизової оболонки шлунка тонкої кишки.
2. Зміна місцевого неспецифічного протеїназ-інгібіторного потенціалу гастродуоденальної зони у експерименті супроводжувалася характерними для даної патології електронно-мікроскопічними змінами: порушенням нормальної структури епітеліального шару зі збільшенням кількості клітин запального ряду, лейкоцитарною інфільтрацією, порушенням структури головних і парієтальних екзокриноцитів, розростанням сполучної тканини в дні виразок. Указані ушкодження з максимально виразними при індометациновій моделі гострої виразки шлунка, при якій відзначене найбільш виразне пригнічення кислотостабільних інгібіторів.
3. Запальні захворювання гастродуоденальної зони в клініці супроводжуються збільшенням активності місцевих неспецифічних протеїназ шлункового соку, із максимальним збільшенням ЕПА і ТПА у хворих із гіпертрофічним й ерозивним гастритом в порівнянні із пацієнтами без уражень слизової оболонки.
4. Розвиток запальних захворювань гастродуоденальної зони у хворих різних вікових груп приводить до зниження інгібіторного потенціалу неспецифічних протеїназ шлункового соку які синтезуються місцево - КСІ на 75,1% (р<0,001) у дорослих при виразковій хворобі шлунка - і антитриптичної активності на 57,8 % (р<0,001) у дітей при ерозивному гастриті. Розвитку ВХШа сприяє декомпенсований стан протеїназ-інгібіторного балансу в шлунковому вмісті із пригніченням антипротеїназного потенціалу, а при відносно високому рівні інгібіторів протеїназ у шлунковому соку збільшується ризик розвитку ВХДПК.
5. Рівень ЕПА шлункового соку являється ефективним критерієм діагностики й прогнозування виразкових ушкоджень травного тракту. Підвищення ЕПА шлункового соку в 1,5 рази в порівнянні з контролем говорить про наявність поверхневого гастриту й гастродуоденіту з низькою ймовірністю розвитку ВХШ й ВХДПК, в 2 рази – ерозивного гастриту й гастродуоденіту із середнім ступенем імовірності розвитку ВХШ й ВХДПК, а при значенні, перевищуючому контроль в 3 рази й більше – високий ступінь імовірності розвитку ВХШ й ВХДПК.
СПИСОК ОПУБЛІКОВАНИХ ПРАЦЬ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
1. Анисимова Л. В. Состояние местной неспецифической протеиназ-ингибиторной системы при экспериментальной язве слизистой оболочки желудочно-кишечного тракта / Л. В. Анисимова // Архив клинической и экспериментальной медицины. – 2006. - Т.15., №.2.-С.141-144.
2. Анисимова Л. В. Local nonspecific poteinase-inhibitory potential in experimental stressful ulcers of gastro-intestinal mucosa / Л. В. Анисимова // Таврический медико-биологический вестник. -2007.- Т.10, №3.-С.112-114.
3. Анисимова Л.В. Стан місцевого неспецифічного протеїназ-інгібіторного потенціалу при патології слизової оболонки шлунку / Л.В. Анисимова, А.В. Кубишкін, І.О.Бабіч // Лікарська справа Врачебное дело. – 2007. – №4. - С. 62-65. (Особисто здобувачем проведено вивчення стану системи обмеженого протеолізу в експерименті і у хворих, статистична обробка результатів дослідження і написання статті)
4. Кубышкин А. В. Состояние неспецифического протеиназ-ингибиторного потенциала у больных с воспалительными и язвенно-некротическими заболеваниями желудка и двенадцатиперстной кишки / А. В. Кубышкин, Л. В. Анисимова // Український медичний альманах.- 2007.- Т.10., №4.- С. 83-86. (Особисто здобувачем проведено підбір хворих, дослідження механізмів розвитку виразково-некротичних уражень слизової оболонки гастродуоденальної зони і написання статті).
5. Анисимова Л. В. Активация местных неспецифических протеолитических ферментов при моделировании язвенных поражений желудочно-кишечного тракта / Л. В. Анисимова // Проблемы, достижения и перспективы развития медико-биологических наук и практического здравоохранения: Тр. Крым. гос. мед. ун-та им. С.И. Георгиевского. - 2006.-Т.142, Ч. 3.- С.7-10.
6. Пат. 26332 Україна, МПК А 61 В 10/00, G01 N 33/48. Спосіб оцінки стану слизової оболонки шлунка у хворих з гастродуоденальною патологією / Анисимова Л. В., Кубишкін А. В., Харченко В. З., Кривий В. В.; заявитель и патентообладатель Кримський державний медичний університет ім. С.І. Георгієвського. - № U200705991; заявл. 30.05.07; опубл. 10.09.07, Бюл. №14.(Особисто здобувачем проведено підбір хворих, вивчення протеїназ-інгібіторної системи шлункового соку у хворих з гастродуоденальною патологією, обґрунтовано и оформлено запропонований метод огляд літературних джерел).
7. Анисимова Л. В. Протеиназ-ингибиторный потенциал при моделировании экспериментальной НПВП-гастропатии / Л. В. Анисимова // VI-ті читання В.В.Підвисоцького: Бюлетень матер. наук. конф. – Одеса, 2007. – С. 46.
8. Анисимова Л. В. Дисбаланс протеїназ-інгібіторної системи в розвитку пептичної виразки шлунку (експериментально-клінічне дослідження) / Л. В. Анисимова // Матеріали міжнародної конференції молодих вчених “Актуальні проблеми клінічної, експериментальної та профілактичної медицини” - Донецьк, 2007.- С.139.
АНОТАЦІЯ
Анисимова Л. В. Значення місцевих неспецифічних протеолітичних механізмів у розвитку виразкових уражень шлунково-кишкового тракту. – Рукопис.
Дисертація на здобуття наукового ступеня кандидата медичних наук за спеціальністю 14.03.04 – патологічна фізіологія. – Донецький національний медичний університет ім. М. Горького МОЗ України, Донецьк, 2008.
Дисертацію присвячено проблемі встановлення ролі місцевих неспецифічних протеїназ і їх інгібіторів у розвитку виразкових уражень травного тракту. Робота базується на аналізі результатів експериментальних досліджень, які були виконані на білих щурах з двома експериментальними моделями гострої виразки і клінічних досліджень хворих різних вікових груп з патологією гастродуоденальної зони. Встановлено, що при розвитку гострої виразки у тварин спостерігається активація місцевих неспецифічних протеолітичних ферментів і пригнічення їх інгібіторів у змивах шлунка і тонкого кишечнику, супернатантах слизової оболонки тонкого кишечнику і стравохідного і фундального відділів шлунка. У хворих спостерігається підвищення неспецифічних протеїназ і пригнічення їх інгібіторів у шлунковому соці. Рівень підвищення неспецифічних протеїназ свідчить про ступінь важкості запального процесу, що перебігає в слизовій оболонці шлунка і дванадцятипалої кишки.
Ключові слова: пептична виразка, протеїназ-інгібіторна система, обмежений протеоліз.
АННОТАЦИЯ
Анисимова Л. В. Значение местных неспецифических протеолитических механизмов в развитии язвенных поражений желудочно-кишечного тракта. – Рукопись.
Диссертация на соискание ученой степени кандидата медицинских наук по специальности 14.03.04 - патологическая физиология. - Донецкий национальный медицинский университет им. М. Горького, Донецк, 2008.
Диссертация посвящена проблеме установления роли местных неспецифических протеиназ и их ингибиторов в развитии язвенных поражений пищеварительного тракта. Исследования базируются на анализе результатов экспериментальных исследований, которые были выполнены на 24 белых крысах-самцах линии “Vistar” массой тела 180 – 200 г. с индометациновой и стрессовой экспериментальными моделями острой язвы и клинических исследований 165 пациентов с различной патологией слизистой оболочки гастродуоденальной зоны из которых: 42 человека взрослых и 123 детей. В результате проведенных исследований местной неспецифической протеиназ-ингибиторной системы пищеварительного тракта установлено, что при развитии острой язвы у экспериментальных животных наблюдается повышение местных неспецифических протеолитических ферментов (эластазоподобной и трисиноподобной активности) и угнетение их ингибиторов (кислотостабильных ингибиторов) в смыве желудка, смыве тонкого кишечника, гомогенате супернатанта слизистой оболочки тонкого кишечника, гомогенате супернатанта слизистой оболочки пищеводного отдела желудка, гомогенате супернатанта слизистой оболочки фундального отдела желудка. Изменение местного неспецифического протеиназ-ингибиторного потенциала гастродуоденальной зоны у экспериментальных животных сопровождалось характерными для данной патологии структурными изменениями. Проведенные исследования показали, что у крыс, которым моделировали острую язву, имеют место отек слизистой с кровоточащими язвами и множественными эрозиями желудка, которые были наиболее выражены в фундальном отделе. Электронно-микроскопическое исследование язв выявило нарушение нормальной структуры эпителиального пласта, с хаотически расположенными клетками однорядного железистого призматического эпителия между которыми, обнаруживались единичные клетки воспалительного ряда и элементы клеток собственных желез желудка. В участках с язвенными дефектами наблюдалась лейкоцитарная инфильтрация.
У больных наблюдается повышение неспецифических протеиназ и снижение их ингибиторов в желудочном соке. Уровень повышения местных неспецифических протеиназ свидетельствует о степени тяжести воспалительного процесса, протекающего в слизистой оболочки желудка и двенадцатиперстной кишке. При повышении выраженности деструкции слизистой оболочки желудка увеличивается уровень активности трипсиноподобных и эластазоподобных протеиназ, а уровень активности кислотостабильных ингибиторов, которые в норме угнетают ферментативную активность, истощается. У пациентов при развитии язвенной болезни двенадцатиперстной кишки на фоне повышенного уровня активности местных неспецифичных протеиназ отмечается компенсированное состояние ингибиторного потенциала. Наличие определенных закономерностей в изменении состояния местной неспецифической протеиназ-ингибиторной системе, которые проявляются повышением уровня активности неспецифических протеиназ и снижением активности их ингибиторов, как у экспериментальных животных, так и у людей с патологией слизистой оболочки гастродуоденальной зоны говорит об участии данной системы в механизмах деструкции и защиты слизистой оболочки желудка и двенадцатиперстной кишки. Преимущество активности местных неспецифических протеиназ над их ингибиторами является важным звеном патогенеза язвенной болезни желудка и двенадцатиперстной кишки.
Ключевые слова: пептическая язва, протеиназ-ингибиторная система, ограниченный протеолиз.
SUMMARY
Anisimova L.V. Role of local nonspecific protheolytical mechanisms in development of ulcer defeats of a gastrointestinal tract. - Тhe Manuscript.
The dissertation for obtaining degree of candidate of medical sciences by specialty 14.03.04 - pathological physiology. – M. Gorky Donetsk National Medical University. Ministry of Health of Ukraine, Donetsk, 2008.
The dissertation is devoted to a problem of establishment of role local nonspecific proteinases and their inhibitor in development of the ulcerous defeats of the digestive tract. Researches are based on analysis result experimental studies, which were run for white rats with two experimental models of the acute gastric ulcer and clinical studies patient different age groups with pathology gastroduodenal zones. In development of the acute gastric ulcer in animal has shown activation local nonspecific proteolytic enzyme and depression their inhibitor in gastric washout, intestinal washout, extract of mucous membrane of the thin intestines, esophageal part and fundal part of a stomach. Increasing nonspecific proteinases and reduction their inhibitor was observed in sick patient’s gastric juices. The level of increasing nonspecific proteinases is indicative of degree of gravity of the inflammatory process which takes please in mucous membrane of stomach and duodenum.
Key words: a stomach ulcer, nonspecific protheinases, limited protheolysis.
Перелік умовних скорочень
АТА ‑ антитриптична активність
ВХШ ‑ виразкова хвороба шлунка
ВХДПК ‑ виразкова хвороба дванадцятипалої кишки
ЕПА ‑ еластазоподібна активність
КСІ ‑ кислотостабільні інгібітори
ТПА ‑ трипсиноподібна активність
Похожие работы
... амілази і пуллуланази або альфа-амілази і глюкоамілази, активних при високій температурі. Однак складність культивування анаеробних бактерій в заводських умовах робить цей спосіб отримання препарату амілолітичних ферментів практично непридатним. З літературних даних відомо, що найбільш термостабільними гідролітичними ферментами, такими як альфа-амілази, пуллуланази, а в ряді випадків і протеази є ...
... і виразкова хвороба дванадцятипалої кишки часто розглядається разом з ВХ шлунку, тому в даній роботі також буде зустрічатися такий поєднаний опис і порівняння. Зразу зауважимо, що на структурно-функціональну характеристику ТК буде мати вплив (давати наслідки) як виразкова хвороба ДПК, так і виразкова хвороба шлунку. У залежності від локалізації виразки і особливостей патогенезу хвороби розрі ...
... коліт - хронічне запально-дистрофічне захворювання товстої кишки, що призводить до морфологічних змін слизової оболонки і порушення моторної, секреторної, всмоктувальної та інших функцій кишечника. Для захворювання характерні запальні зміни слизової оболонки (набряк, помірно виражена інфільтрація слизової оболонки лейкоцитами, ерозії) з наступним розвитком атрофічних і склеротичних процесів. ...

0 комментариев