Навигация
Кондуктометрический метод анализа и его использование в анализе объектов окружающей природной среды
Кондуктометрический метод анализа и его использование в анализе объектов окружающей природной среды
Введение
К началу XXI века стало ясно, что электрохимический анализ, как и сама аналитическая химия, вышел за пределы своего классического содержания. Если раньше методология электрохимического анализа по большей части развивалась на основе изучения объектов неорганической природы, то сейчас электрохимический анализ устойчиво «дрейфует» в сторону решения проблем экологии, анализа биологических и медицинских объектов, в которых органическое вещество встречается все чаще и чаще. В решении задач собственно электрохимического анализа актуальным становится конструирование модифицированных электродов, которые дают специфический отклик благодаря иммобилизации на электроде органических молекул или их фрагментов, например ДНК или ее олигомеров. Повышение интереса к анализу объектов органической природы предопределено тем, что число последних на несколько порядков превышает число ионов металлов и их соединений. При этом все шире используется разнообразие электродных процессов, более сложных форм электрического воздействия на изучаемый объект и преобразования аналитического сигнала, в том числе на основе достижений математики, информатики и электронной техники. Очевидно, что необходимый уровень знаний в этой сфере является непременным условием успешной деятельности специалистов в области электрохимического анализа, способных творчески применять и развивать указанные методы. Одним из распространенных методов является кондуктометрия. Кондуктометрия используется в работе анализаторов детергентов в сточных водах, при определении концентраций синтетических удобрений в оросительных системах, при оценке качества питьевой воды. В дополнение к прямой кондуктометрии для определения некоторых видов загрязнителей могут быть использованы косвенные методы, в которых определяемые вещества взаимодействуют перед измерением со специально подобранными реагентами и регистрируемое изменение электропроводности вызывается только присутствием соответствующих продуктов реакции. Кроме классических вариантов кондуктометрии применяют и ее высокочастотный вариант (осциллометрию), в котором индикаторная электродная система реализуется в кондуктометрических анализаторах непрерывного действия.
1. Теоретические основы кондуктометрического метода анализа
Кондуктометрические методы анализа основаны на измерении электропроводности исследуемых растворов. Существует несколько методов кондуктометрического анализа:
· прямая кондуктометрия – метод, позволяющий непосредственно определять концентрацию электролита путем измерения электропроводности раствора с известным качественным составом;
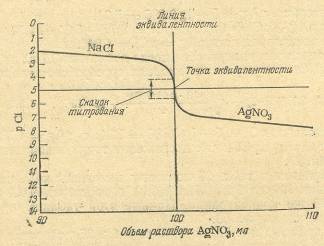
· кондуктометрическое титрование – метод анализа, основанный на определении содержания вещества по излому кривой титрования. Кривую строят по измерениям удельной электропроводности анализируемого раствора, меняющейся в результате химических реакций в процессе титрования;
· хронокондуктометрическое титрование – основано на определении содержания вещества по затраченному на титрование времени, автоматически фиксируемого на диаграммной ленте регистратора кривой титрования.
Кондуктометрия
Кондуктометрия относится к наиболее распространенным методам исследования растворов и жидких систем вообще.
· проводящими принято условно с χ ~10-7 Ом-1·см-1 и выше;
· умеренно проводящими с χ: 10-7 – 10-11 Ом-1 ·м-1;
· непроводящими – χ ниже 10-11 Ом-1 ·м-1.
Данная классификация условна.
В ФХА принято пользоваться диаграммами «удельная электропроводность χ – состав». Поскольку электропроводность относится к заведомо не аддитивным свойствам, способ выражения концентрации при этом может быть произвольным, однако для наглядности чаще всего выбирают мольные доли. Диаграммы «молекулярная электропроводность λ – состав» используется реже.
Электрическое сопротивление
Основной константой, характеризующей электрические свойства вещества, является удельное электрическое сопротивление, зависящее от природы вещества и от температуры.
Согласно закону Ома удельное электрическое сопротивление (ρ) [Ом·м]:
![]() ,
,
где R – электрическое сопротивление, ом; S – площадь поперечного сечения, м2; l – длина, м.
Температурная зависимость электрического сопротивления металлов подчиняется закону:
ρt = ρ0 (1+αt),
где α – температурный коэффициент.
Электрическая проводимость обусловлена движением заряженных частиц и зависит от количества носителей заряда и их подвижности.
Для разбавленных твердых растворов, их удельное электрическое сопротивление по правилу Маттиссена представлено из двух слагаемых:
ρ = ρ(t) + ρ(x),
где ρ(t) – электрическое сопротивление чистого металла, зависящее от температуры метала; ρ(x) – остаточное электрическое сопротивление, не зависящее от температуры и определяется типом примеси и ее концентрацией.
Эта формула применима при содержании примеси до 1 ат.% Согласно правилу Линде, добавочное электрическое сопротивление, вызываемое содержанием примеси 1 ат.%, пропорционально квадрату разности валентностей чистого металла и примеси (∆z):
∆ρ(x) = a + b(∆z)2,
где a, b – величины, определяющие свойства металла – растворителя.
Правило Маттиссена достаточно хорошо выполняется для большинства разбавленных металлических расплавов, правилу Линде многие расплавы не подчиняются.
Механизм электрической проводимости в металлических расплавах и твердых металлах принципиально не различается.
Переход металла из твердого в жидкое состояние сопровождается некоторым изменением электрических свойств: при плавлении удельное электросопротивление большинства металлов увеличивается в 1,5÷2 раза. Для некоторых металлов (Bi, Sb, As) характерно аномальное поведение: при плавлении их удельное электросопротивление уменьшается.
Электрическая проводимость оксидных расплавов близка к электропроводимости типичных электролитов (галлогениды щелочных металлов) и зависит от состава шлака и температуры. Это является одним из доказательств ионной теории строения шлаковых расплавов.
Их ионная структура определяет преимущественно ионную проводимость в расплавленном состоянии. Электропроводимость определяется, в первую очередь, размерами катионов и анионов и силами взаимодействия между ними.
Повышение температуры увеличивает электропроводимость оксидных расплавов. При переходе из твердого состояния в жидкое электропроводимость резко возрастает.
Уравнение Я.И. Френкеля характеризует температурную зависимость электропроводимости ионных кристаллов:
![]()
Уравнение применимо и для оксидных расплавов, в которых перенос тока осуществляется только катионами (которые много меньше по размеру, чем анионы), т.е. если радиусы анионов велики по сравнению с катионами, и анионы остаются почти неподвижными в электрическом поле.
При соблюдении уравнения Я.И. Френкеля экспертные данные укладываются в прямолинейную зависимость ![]() . Отклонения свидетельствуют о структурных изменениях, которые могут быть связаны с разложением комплексных анионов на простые.
. Отклонения свидетельствуют о структурных изменениях, которые могут быть связаны с разложением комплексных анионов на простые.
![]() .
.
Контактные методы измерения электрической проводимости расплавов
В основе лежит закон Ома: на фиксированном участке проводника из жидкого металла, имеющего длину l и площадь поперечного сечения S, определяется электросопротивление Rχ.
Из соотношения ![]() устанавливают значения удельной электропроводимости металла.
устанавливают значения удельной электропроводимости металла.
Для определения электросопротивления проводника применяют следующие электрические измерительные схемы:
· схема вольтметра-амперметра, в которой при помощи вольтметра измеряют падение напряжения на концах проводника Vx, а амперметром – силу тока I. В этом случае значение Rx определяют по закону Ома: ![]() . Точность метода невысока (≤ 1%) и определяется классом точности приборов.
. Точность метода невысока (≤ 1%) и определяется классом точности приборов.
· Компенсационный метод: в цепь включают эталонное сопротивление Rэ и с помощью потенциометра измеряют падение напряжения на проводнике Vx и эталоне Vэ. Расчет по формуле: ![]() более точный метод.
более точный метод.
· С использованием моста Уитстона или двойного моста Томсона. Точность 0,2–0,3%, но необходимо учитывать контактные сопротивления и сопротивление проводов.
Определение электропроводимости расплавов связано с техническими трудностями: контакт расплава с электродами, подбор материалов.
Конструкции измерительных ячеек с различным расположением калиброванного канала, в котором проводник из жидкого металла, электроды токовые и потенциальные.
Для расчета удельного электрического сопротивления (или электрической проводимости) по измеренному (методом моста или методом вольтметра-амперметра) значению электрического сопротивления расплава необходимо знать константу ячейки. Градуировку ячейки обычно производят водным раствором (при комнатной температуре) или расплавом NaCl или KCl (при 700–900 °С).
Значение константы ячейки определяют по формуле:
![]() ,
,
где r – сопротивление проводящих проводов и электродов при соответствующих температурах опыта; Rx – измеряемое сопротивление.
Одним из способов определения r является предварительное определение.
Чаще используют другой метод, заключающийся в измерении электросопротивления при двух последовательных погружениях электродов на различную глубину. Этот способ позволяет исключить поправку на сопротивление проводов (r), т. к. расчет удельного электрического сопротивления ведут по разности измеренных сопротивлений:
![]() ,
,
где К1 и К2 – константы ячейки при двух последовательных погружениях электродов.
Конструкция установки разработанной Б.М. Лепинских и О.А. Есиным (УПИ) с мостовой схемой измерения и ячейкой типа электрод-электрод.
Регулирование глубины погружения электродов производится вращением стержня (#), при этом происходит подъем или опускание тигля при неподвижных электродах.
Среднее значение константы ячейки устанавливают градуированием по 0,1 н раствору KCl. Этот метод используется для определения электрической проводимости двойных шлаковых систем. Схема моста позволяет измерять сопротивление расплавов с точностью до 0,01 ом. Относительная ошибка определения удельной электрической проводимости двойных шлаковых систем. Схема моста позволяет измерять сопротивление расплавов с точностью до 0,01 ом. Относительная ошибка определения удельной электрической проводимости достигает 11,8%.
Кондуктометрия располагает несколькими законами:
1. В очень разбавленных растворах (предельно разбавленных) эквивалентная электропроводность (λ0) является постоянной характеристикой раствора, не зависящей от изменения концентрации электролита. Говоря простым языком, это означает, что в разбавленных растворах электропроводность прямопропорциональна количеству заряженных частиц – ионов.
Для растворов сильных электролитов область предельного разбавления простирается до концентрации 0,0001н, а с небольшой погрешностью можно считать границей предельного разбавления концентрацию 0,001н.
Для расчетов в области больших концентраций существует формула Кольрауша, но ее нельзя использовать для прогноза, поскольку она носит явно эмпирический характер:
λ = λ0 + K C 1/2,
Похожие работы
... . Комбинированные методы дают дополняющую друг друга информацию, позволяющую произвести правильную идентификации веществ, которые не могут быть опознаны с помощью какого- либо одного метода.[11-12] Глава 3. Примеры применения хроматографии в анализе объектов окружающей среды Анализ состояния водной среды с помощью метода газовой хроматографии[13-15] Метод газовой хроматографии для анализа ...
... образом точно соответствует их взаимному положению в периодической системе элементов: америций (№ 95), кюрий (№ 96), берклий (№ 97) и калифорний (№ 98).[4, 11-16] ГЛАВА 2. ПРИМЕРЫ ИСПОЛЬЗОВАНИЯ ИОНООБМЕННОЙ ХРОМАТОГРАФИИ В АНАЛИЗЕ ОБЪЕКТОВ ОКРУЖАЮЩЕЙ СРЕДЫ Внеколоночное образование ионной пары для разделения смеси карбоновых и оксикислот методом ион-парной вэжх[17] Определение оптически ...
... и природы вещества, участвующего в электрохимической реакции. Электрохимические параметры при этом служат аналитическими сигналами, при условии, что они измерены достаточно точно. Электрохимические методы анализа в практику химического анализа вошли сравнительно давно и занимают в ней важную роль. Впервые потенциометрическое титрование было проведено в 1893 г. в институте Оствальда в Лейпциге, а ...
... эквивалентности раствор обесцвечивается. Избыток [Hg2]2+-ионов реагирует с Fe(SCN)3 по уравнению: 3 [Hg2]2+ + 2 Fe(SCN)3 → 3Hg2(SCN)2 + 2Fe3+ 2.3 Инструментальные методы определения хлорид-ионов 2.3.1 Нефелометрическое определение хлоридов При прохождении пучка света через дисперсные системы наблюдается рассеяние или поглощение света твердыми частицами. Это явление положено в ...









0 комментариев