Навигация
Кислотные осадки представляют собой различные виды атмосферных осадков (дождь, снег, туман, роса) с кислотностью выше нормы.

1. Понятие кислотности
Кислотность водного раствора определяется присутствием в нем положительных водородных ионов Н+ и характеризуется концентрацией этих ионов в одном литре раствора C(H+) (моль/л или г/л). Щелочность водного раствора определяется присутствием гидроксильных ионов ОН– и характеризуется их концентрацией C(ОН–).
Как показывают расчеты, для водных растворов произведение молярных концентраций водородных и гидроксильных ионов – величина постоянная, равная
C(H+)C(ОН–) = 10–14,
другими словами, кислотность и щелочность взаимосвязанны: увеличение кислотности приводит к снижению щелочности, и наоборот.
Раствор является нейтральным, если концентрации водородных и гидроксильных ионов одинаковы и равны (каждая) 10–7 моль/л. Такое состояние характерно для химически чистой воды.
Из сказанного следует, что для кислых сред выполняется условие:
10–7 < C(H+) 100,
для щелочных сред:
10–14 C(H+) < 10–7.
На практике степень кислотности (или щелочности) раствора выражается более удобным водородным показателем рН, представляющим собой отрицательный десятичный логарифм молярной концентрации водородных ионов:
рН = –lgC(H+).
Например, если в растворе концентрация водородных ионов равна 10–5 моль/л, то показатель кислотности этого раствора рН = 5. При этом изменению показателя кислотности рН на единицу соответствует десятикратное изменение концентрации водородных ионов в растворе. Так, концентрация водородных ионов в среде с рН = 2 в 10, 100 и 1000 раз выше, чем в среде с рН = 3, 4 и 5 соответственно.
В кислых растворах рН < 7, и чем меньше, тем кислее раствор. В щелочных растворах рН > 7, и чем больше, тем выше щелочность раствора.
Шкала кислотности идет от рН = 0 (крайне высокая кислотность) через рН = 7 (нейтральная среда) до рН = 14 (крайне высокая щелочность). Показатель кислотности рН различных веществ, встречающихся в повседневной жизни, приведен на рис. 1.
Чистая природная, в частности дождевая, вода в отсутствие загрязнителей тем не менее имеет слабокислую реакцию (рН = 5,6), поскольку в ней легко растворяется углекислый газ с образованием слабой угольной кислоты:
СО2 + Н2О ![]() Н2СО3.
Н2СО3.
Для определения показателя кислотности используют различные рН-метры, в частности дорогостоящие электронные приборы. Простым способом определения характера среды является применение индикаторов – химических веществ, окраска которых изменяется в зависимости от рН среды. Наиболее распространенные индикаторы – фенолфталеин, метилоранж, лакмус, а также естественные красители из красной капусты и черной смородины.
Достаточно точно показатель кислотности рН измеряется с помощью индикаторной бумаги, содержащей кислотореагирующие пигменты.
2. Основные антропогенные источники кислотообразующих выбросов
Главные кислотообразующие выбросы в атмосферу – диоксид серы SO2 (cернистый ангидрид, или сернистый газ) и оксиды азота NОх (монооксид, или оксид азота NО, диоксид азота NO2 и др.).
Природными источниками поступления диоксида серы в атмосферу являются главным образом вулканы и лесные пожары. Естественная фоновая концентрация SО2 в атмосфере достаточно стабильна, включена в биохимический круговорот и для экологически благополучных территорий России равна 0,39 мкг/м3 (Арктика) – 1,28 мкг/м3 (средние широты). Эти концентрации значительно ниже принятого в мировой практике предельно допустимого значения (ПДК) по SО2, равного 15 мкг/м3.
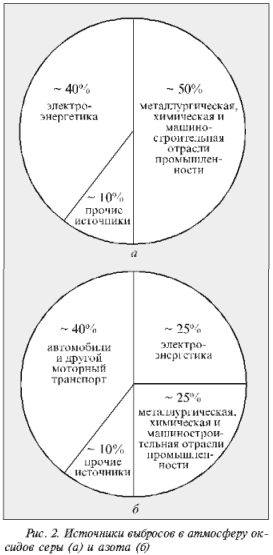
Общее количество диоксида серы антропогенного происхождения в атмосфере сейчас значительно превышает ее естественное поступление и составляет в год около 100 млн т (для сравнения: природные выбросы SO2 в год равны примерно 20 млн т). Из них на долю США приходится 20%, на долю России – менее 10%. Диоксид серы образуется при сжигании богатого серой горючего, такого, как уголь и мазут (содержание серы в них колеблется от 0,5 до 5–6%), на электростанциях (~40% антропогенного поступления в атмосферу), в металлургических производствах, при переработке содержащих серу руд, при различных химических технологических процессах и работе ряда предприятий машиностроительной отрасли промышленности (~50%).
При сжигании каждого миллиона тонн угля выделяется около 25 тыс. т серы в виде главным образом ее диоксида (до триоксида окисляется менее 3% серы); в 4–5 раз меньше окисленной серы дает сжигание мазута.
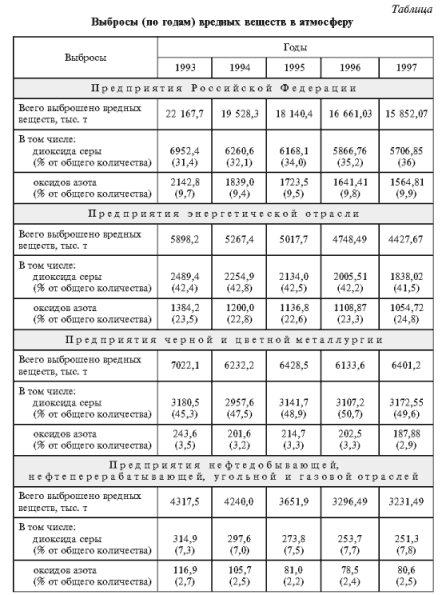
Как показывают данные, приведенные в таблице, в России выбросы диоксида серы составляют более 30% всех вредных промышленных выбросов. На предприятиях энергетической отрасли промышленности, черной и цветной металлургии доля выбросов диоксида серы составляет примерно 40 и 50% соответственно (см. табл.). Меньше доля выбросов SO2 предприятиями нефтедобывающей, нефтеперерабатывающей, угольной и газовой отраслей промышленности (см. табл.) – около 8% собственных выбросов загрязняющих веществ и около 5% суммарных выбросов и оксида серы предприятиями России, хотя предприятия этих отраслей дают примерно пятую часть всех техногенных выбросов загрязняющих веществ.
Анализ техногенных источников выбросов сернистого газа в атмосферу показывает, что выбросы производят высокоразвитые промышленные страны, и это становится проблемой в первую очередь для них и их ближайших соседей.
Данные мониторинга воздушной атмосферы свидетельствуют об увеличении в последние годы доли выбросов азотных соединений в закисление атмосферных осадков.
Содержанию оксидов азота в атмосфере стали уделять внимание лишь после обнаружения озоновых дыр в связи с открытием азотного цикла разрушения озона.
Природные поступления в атмосферу оксидов азота связаны главным образом с электрическими разрядами, при которых образуется NО, впоследcтвии – NО2. Значительная часть оксидов азота природного происхождения перерабатывается в почве микроорганизмами, т. е. включена в биохимический круговорот. Для экологически благополучных районов России естественная фоновая концентрация оксидов азота равна 0,08 мкг/м3 (Арктика) – 1,23 мкг/м3 (средние широты), что существенно ниже ПДК, равного 40 мкг/м3.
Оксиды азота техногенного происхождения образуются при сгорании топлива, особенно если температура превышает 1000 °С. При высоких температурах часть молекулярного азота окисляется до оксида азота NО, который в воздухе немедленно вступает в реакцию с кислородом, образуя диоксид NO2 и тетраоксид диазота N2O4. Первоначально образующийся диоксид азота составляет лишь 10% выбросов всех оксидов азота в атмосферу, однако в воздухе значительная часть оксида азота превращается в диоксид – гораздо более опасное соединение.
При высокотемпературном сгорании органического природного топлива происходят реакции двух типов: между кислородом воздуха и азотом, содержащимся в топливе (в угле содержание азота составляет в среднем около 1%, нефти и газе – 0,2–0,3%), и между кислородом воздуха и азотом, также содержащимся в воздухе.
Техногенные мировые выбросы оксидов азота в атмосферу составляют в год около 70 млн т (природные выбросы оксидов азота, по некоторым оценкам, равны в год 700 млн т), примерно 30% их приходится на долю США, 25% – на долю стран Западной Европы и лишь несколько процентов – на долю России (см. табл.). Суммарные антропогенные выбросы оксидов азота в атмосферу больше. Дополнительный источник таких выбросов – сельское хозяйство, интенсивно использующее химические удобрения, в первую очередь содержащие соединения азота. Вклад этой отрасли мирового хозяйства в загрязнение атмосферы оксидами азота учесть трудно, по некоторым данным, поступление оксидов азота в атмосферу с сельскохозяйственных полей сопоставимо с промышленными выбросами.
В России (см. рис. 2) около 25% выбросов оксидов азота дает сжигание топлива на предприятиях электро- и теплоэнергетики, столько же – на предприятиях металлургической, машиностроительной и не связанной с процессами горения топлива химической отраслей промышленности (например, получение азотной кислоты и взрывчатых веществ). Главный источник техногенных оксидов азота в атмосфере – автотранспорт и другие виды моторного транспорта (около 40%). Распределение выбросов оксидов азота по основным отраслям промышленного производства приведены в таблице.
Следует отметить, что при наметившейся в 1990-е гг. в России тенденции снижения выбросов загрязняющих веществ промышленными предприятиями (см. табл.) доля диоксида серы и оксидов азота в этих выбросах увеличивается.
Суммарные выбросы всех загрязнителей в воздушную среду в 1997 г. по сравнению с 1993 г. сократились примерно на 30%, диоксида серы – примерно на 20%, оксидов азота – на 30%.
Однако лишь 20% этих сокращений обусловлены природоохранными мероприятиями и усилением экологического контроля. Основная причина – спад производства, который за эти годы составил более 50%. Расхождение между относительными показателями спада производства и сокращения выбросов свидетельствует о росте отрицательного техногенного воздействия на окружающую среду в расчете на единицу произведенного продукта. Как показывает анализ, спад производства был неравномерен в различных отраслях хозяйства – наименьшим он оказался в самых экологически напряженных секторах (энергетика, металлургия и др.) и наибольшим – в отраслях, оказывающих относительно слабое воздействие на окружающую среду (машиностроение, оборонная отрасль промышленности и др.), при этом выбросы автотранспорта возросли, причем в крупных городах – очень значительно.
Отметим еще два – экономических – аспекта рассматриваемой проблемы, оказывающих большое влияние на общую экологическую ситуацию в России, в том числе и связанную с кислотными осадками. К началу спада производства в России (1991) на предприятиях срок эксплуатации наличного промышленного оборудования был запредельным, в базовых отраслях промышленности (среди них те, что дают наибольшие кислотообразующие выбросы) средний возраст оборудования приближался к 30 годам. Изношенное оборудование требует больше ресурсов для эксплуатации, производит больше отходов, отличается повышенной аварийностью. Помимо отсутствия средств на капитальные затраты предприятия не имеют средств и на текущие затраты. В этих критических условиях для снижения удельных затрат на производимую продукцию предприятие экономит на всем и в первую очередь на охране окружающей среды, строительстве или модернизации очистных сооружений и других мероприятиях.
Как следует из ежегодных государственных докладов Госкомэкологии «О состоянии окружающей природной среды в Российской Федерации», данных мониторинга Росгидромета, во многих регионах даже сократившийся поток загрязнений превосходит ассимиляционный потенциал соответствующих экосистем, т. е. является для них заведомо чрезмерным.
Похожие работы
... в верхние слои и распыляется над сушей. Однако следует учитывать тот факт, что из сульфатов морского происхождения не может образовываться серная кислота, поэтому с точки зрения образования кислотных дождей они не имеют существенного значения. Их влияние сказывается лишь на регулировании образования облаков и осадков. Антропогенные источники эмиссии серы в атмосферу: В результате деятельности ...
... образованием угольной кислоты (H2CO3). Чистый дождь, проходящий через незагрязненный воздух, представляет собой водный раствор с pH 5,6 (к моменту удара о землю). Как мы увидим дальше, основная причина выпадения кислотных дождей — это деятельность человека, однако есть и естественные причины, начиная с извержения вулканов и разряда молнии и кончая жизнедеятельностью бактерий. В общем, даже если бы ...
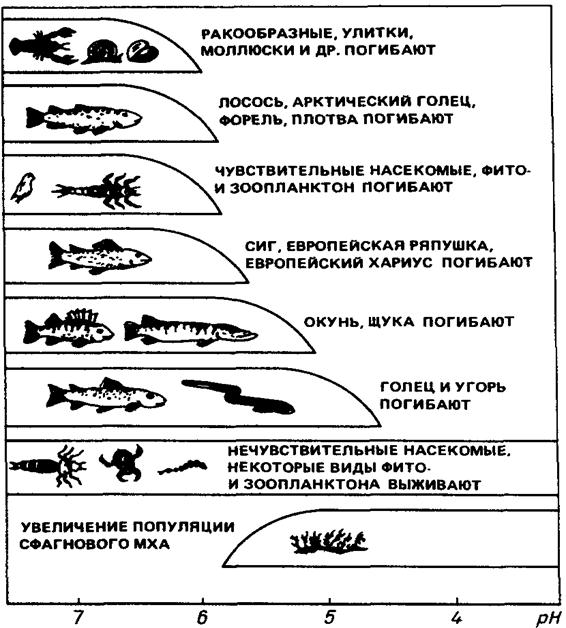
... поверхности направлении ощущается увеличение скорости ветра и горизонтальное движение воздуха вызывает турбулентность. Таким путем компоненты воздуха достигают Земли, и наиболее активные кислотные вещества легко взаимодействуют с поверхностью. Влияние кислотных осадков на биосферу. Кислотные осадки оказывают вредное воздействие не только на отдельные предмет или живые существа, но и на их ...



0 комментариев