Навигация
СОДЕРЖАНИЕ
Введение
I. Понятие кислотности
II. Механизм образования и выпадения кислотных осадков
III. Влияние кислотных дождей на экосистемы и людей
Заключение
Список используемой литературы
ВВЕДЕНИЕ
Актуальность изучения данной темы непосредственно связана с все более ухудшающейся экологической ситуацией, как в нашей стране, так и непосредственно во всем мире.
Подчеркивая данное обстоятельство, необходимо отметить, что несколько лет назад выражения «кислотные осадки» и «кислотные дожди» были известны лишь исключительно ученым, посвященным в определенных, специализированных областях экологии и химии атмосферы. За последние несколько лет эти выражения стали повседневными, вызывающими беспокойство словами во многих странах во всем мире [2, с. 3].
Кислотные осадки являются проблемой, которая в случае ее бесконтрольного развития, может вызвать в результате существенные экономические и социальные издержки.
Окисление почв и вод – это комплекс причин, исходных условий и следующих один за другим процессов в химической и биологической системах, которые мы обобщенно называем нашей окружающей средой [2, с. 3].
Часть процессов окисления является природной, но данные изменения кислотности в системах почвы и воды, ни по скорости, ни по общему охвату, не могут быть сравнены с окислением, ставшим результатом собственной деятельности человека в промышленной и энергетической областях, а также в определенной части современного использования земли.
Предмет исследования – процесс образования и выпадения кислотных осадков.
Объект исследования – кислотные осадки.
Исходя из всего вышеизложенного, целью данной работы является необходимость охарактеризовать сущность понятия «кислотный дождь», а также описать влияние этого явления на экосистемы и людей.
Достижение данной цели предполагает решение ряда следующих актуальных задач:
1. Определить понятие «кислотность».
2. Охарактеризовать механизм образования и выпадения кислотных осадков.
3. Выделить основные особенности влияния кислотных дождей на экосистему и людей.
В процессе написания данной работы нами были использованы следующие методы:
1. Анализ источников и используемой литературы.
2. Сравнительный метод.
Данная работа была написана с использованием учебной и монографической литературы.
1 Понятие кислотности
Чтобы более полно охарактеризовать понятие «кислотный дождь», на наш взгляд, необходимо определиться с терминологией. На необходимо отметить, что, несмотря на «постиндустриальное» звучание, этому термину уже более ста лет.
Впервые он был употреблен в 1872 году англичанином Ангусом Смитом, изучавшим эффекты смога в Манчестере, однако тогдашние ученые коллегу не поддержали и к теории кислотных дождей отнеслись скептически. Сегодня же в их существовании нет никаких сомнений [7, с. 70].
В силу этого, нам необходимо рассмотреть само понятие «кислотность».
Термин «кислотность водного раствора» - это химический термин. Кислотность водного раствора определяется присутствием в нем положительных водородных ионов Н+ и характеризуется концентрацией этих ионов в одном литре раствора C(H+) (моль/л или г/л). Щелочность водного раствора определяется присутствием гидроксильных ионов ОН– и характеризуется их концентрацией C(ОН–) [7, с. 70].
Как показывают расчеты, для водных растворов произведение молярных концентраций водородных и гидроксильных ионов – величина постоянная, равная C(H+)·C(OH–) = 10–14, другими словами, кислотность и щелочность взаимосвязаны: увеличение кислотности приводит к снижению щелочности, и наоборот.
Раствор является нейтральным, если концентрации водородных и гидроксильных ионов одинаковы и равны (каждая) 10–7 моль/л. Такое состояние характерно для химически чистой воды.
Из сказанного следует, что для кислых сред выполняется условие:
10–7 < C(H+) ≤ 100, а для щелочных сред: 10–14 ≤ C(H+) < 10–7.
В 1909 г. Сорензеном было предложено применять вместо подлинных значений C(H+) и C(ОН–) их отрицательные логарифмы, чтобы избавиться от отрицательных степеней в значениях C(H+) и C(ОН–). Отрицательный десятичный логарифм концентрации водородных ионов называется водородным показателем и обозначается pH: pH = – lg C(H+).
Шкала кислотности идет от pH = 0 (крайне высокая кислотность) через pH = 7 (нейтральная среда) до pH = 14 (крайне высокая щелочность). Показатель кислотности pH различных веществ, встречающихся в повседневной жизни [7, с. 70].
Изменение значения pH на единицу соответствует изменению концентрации ионов водорода в 10 раз.
Чистая дождевая вода имеет слабокислый показатель водорода, так как в ней присутствуют катионы щелочных элементов (Na+, K+) и анионы, такие как HCO ![]() , CO
, CO ![]() , Cl– и др. В дождевой воде практически нет щелочноземельных элементов (Ca+2, Mg+2), поэтому она мягкая (требуется большое количество этой воды, чтобы смыть мыло или шампунь).
, Cl– и др. В дождевой воде практически нет щелочноземельных элементов (Ca+2, Mg+2), поэтому она мягкая (требуется большое количество этой воды, чтобы смыть мыло или шампунь).
Таким образом, в заключение данного параграфа, мы непосредственно можем сделать следующий вывод, о том, что согласно учению о кислотности, широко распространенный термин «кислотные дожди» обозначает осадки с pH меньше 5,7.
Виной таким изменениям — оксиды серы и азота, в промышленных масштабах выбрасываемые в атмосферу автомобилями, электростанциями, металлургическими заводами. В воздушной среде на частицах сульфатов и нитратов конденсируются молекулы воды, образуются облачные капельки, которые при определенных погодных условиях становятся частью дождевых капель или снежинок. Если концентрация сульфатов и нитратов в атмосфере велика, то дождь или снег получается значительно закисленным [1, с. 198].
II. Механизм образования и выпадения кислотных осадков
По ряду показателей, в первую очередь по массе и распространенности вредных эффектов, атмосферным загрязнителем номер один считают диоксид серы [1, с. 129]
Диоксид серы, попавший в атмосферу, претерпевает ряд химических превращений, ведущих к образованию кислот. Частично диоксид серы в результате фотохимического окисления превращается в триоксид серы (серный ангидрид) SО3, который реагирует с водяным паром атмосферы, образуя аэрозоли серной кислоты: 2SО2 + О2 = 2SО3, SО3 + Н2О=Н2SО4. Основная часть выбрасываемого диоксида серы во влажном воздухе образует кислотный полигидрат SО2 o nН2О, который часто называют сернистой кислотой и изображают условной формулой Н2SО3: SО2 + Н2О=Н2SО3. Сернистая кислота во влажном воздухе постепенно окисляется до серной: 2Н2S03 + 02= 2Н2S04.
Аэрозоли серной и сернистой кислот приводят к конденсации водяного пара атмосферы и становятся причиной кислотных осадков (дожди, туманы, снег). При сжигании топлива образуются твердые микрочастицы сульфатов металлов (в основном при сжигании угля), легко растворимые в воде, которые осаждаются на почву и растения, делая кислотными росы. Аэрозоли серной и сернистой кислот составляют около 2/3 кислотных осадков, остальное приходится на долю аэрозолей азотной и азотистой кислот, образующихся при взаимодействии диоксида азота с водяным паром атмосферы: 2NО2 + Н2О=НNО3 + НNО2.
Существуют еще два вида кислотных дождей, которые пока не отслеживаются мониторингом атмосферы [1, с. 129].
Находящийся в атмосфере хлор (выбросы химических предприятий; сжигание отходов; фотохимическое разложение фреонов, приводящее к образованию радикалов хлора) при соединении с метаном (источники поступления метана в атмосферу: антропогенный – рисовые поля, а также результат таяния гидрата метана в вечной мерзлоте вследствие потепления климата) образует хлоро-водород, хорошо растворяющийся в воде с образованием аэрозолей соляной кислоты:
СL. + СН4 =СH.3 + НС1, СH3. + С12= СН3С1 + СL.
Поступление в атмосферу больших количеств SO2 и окислов азота приводит к заметному снижению рН атмосферных осадков. Это происходит из-за вторичных реакций в атмосфере, приводящих к образованию сильных кислот – серной и азотной. В этих реакциях участвуют кислород и пары воды, а также частицы техногенной пыли в качестве катализаторов:
2SO2 + О2 + 2Н2О ¾® 2H2SO4;
4NO2 + 2Н2O + О2 ¾®4HNO3.
В атмосфере оказывается и ряд промежуточных продуктов указанных реакций. Растворение кислот в атмосферной влаге приводит к выпадению «кислотных дождей».
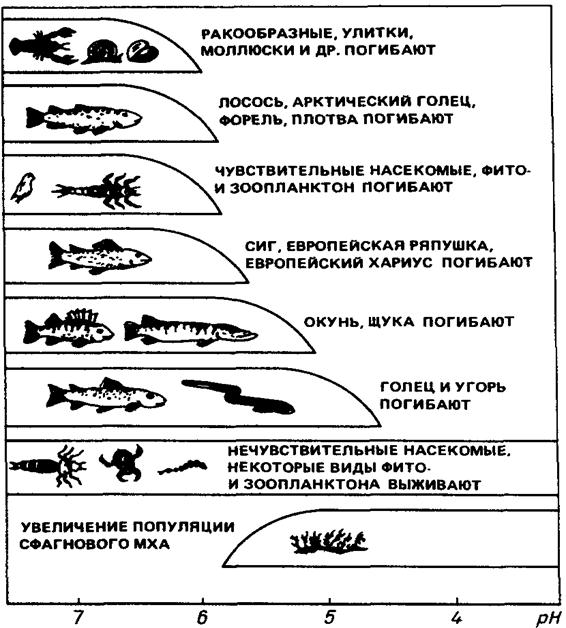
Показатель рН осадков в ряде случаев снижается на 2 – 2,5 единицы, то есть, вместо, нормальных 5,6 – 5,7 до 3,2 – 3,7 [1, с. 130].
Следует напомнить, что рН – это отрицательный логарифм концентрации водородных ионов, и, следовательно, вода с рН = 3,7 в сто раз «кислее» воды с рН = 5,7. В промышленных районах и в зонах атмосферного заноса окислов серы и азота рН дождевой воды колеблется от 3 до 5 [1, с. 130].
Впервые кислотные дожди были отмечены в Западной Европе, в частности в Скандинавии, и Северной Америке в 1950-х гг. Сейчас эта проблема существует во всем индустриальном мире, и приобрела особое значение в связи с возросшими техногенными выбросами оксидов серы и азота. За несколько десятилетий размах этого бедствия стал настолько широк, а отрицательные последствия столь велики, что в 1982 г. В Стокгольме состоялась специальная международная конференция по кислотным дождям, в которой приняли участие представители 20 стран и ряда международных организаций [6, с. 53].
До сих пор острота этой проблемы сохраняется, она постоянно в центре внимания национальных правительств и международных природоохранных организаций. В среднем кислотность осадков, выпадающих в основном в виде дождей в Западной Европе и Северной Америке на площади почти 10 млн. км2, составляет 5-4,5, а туманы здесь нередко имеют рН, равный 3-2,5. В последние годы кислотные дожди стали наблюдаться в промышленных районах Азии, Латинской Америки и Африки. Например, в Восточном Трансваале (ЮАР), где вырабатывается 4/5 электроэнергии страны, на 1 км2 выпадает около 60 т серы в год в виде кислотных осадков [5, с. 49].
В тропических районах, где промышленность практически неразвита, кислотные осадки вызваны поступлением в атмосферу оксидов азота за счет сжигания биомассы. В России наиболее высокие уровни выпадений окисленной серы и оксидов азота (до 750 кг/км2 в год) на значительных по площади ареалах (несколько тыс. км2) наблюдаются в густонаселенных и промышленных регионах страны – в Северо-Западном, Центральном, Центрально-Черноземном, Уральском и других районах; на локальных ареалах (площадью до 1 тыс. км2) – в ближнем следе металлургических предприятий, крупных ГРЭС, а также больших городов и промышленных центров (Москва, Санкт-Петербург, Омск, Норильск, Красноярск, Иркутск и др.), насыщенных энергетическими установками и автотранспортом. Минимальные значения рН осадков в этих местах достигают 3,1-3,4 [5, с. 49].
Специфическая особенность кислотных дождей – их трансграничный характер, обусловленный переносом кислотообразующих выбросов воздушными течениями на большие расстояния – сотни и даже тысячи километров. Этому в немалой степени способствует принятая некогда «политика высоких труб» как эффективное средство против загрязнения приземного воздуха.
Почти все страны одновременно являются «экспортерами» своих и «импортерами» чужих выбросов. Наибольший вклад в трансграничное подкисление природной среды России соединениями серы вносят Украина, Польша, Германия.
В свою очередь, из России больше всего окисленной серы направляется в страны Скандинавии. Соотношения здесь такие: с Украиной – 1:17, с Польшей – 1:32, с Норвегией – 7:1 [5, с. 50].
Экспортируется «мокрая» часть выбросов (аэрозоли), сухая часть загрязнений выпадает в непосредственной близости от источника выброса или на незначительном удалении от него. Обмен кислотообразующими и другими загрязняющими атмосферу выбросами характерен для всех стран Западной Европы и Северной Америки. Великобритания, Германия, Франция больше направляют окисленной серы к соседям, чем получают от них. Норвегия, Швеция, Финляндия больше получают окисленной серы от своих соседей, чем выпускают через собственные границы (до 70% кислотных дождей в этих странах – результат «экспорта» из Великобритании и Германии). Трансграничный перенос кислотных осадков – одна из причин конфликтных взаимоотношений США и Канады.
Похожие работы
... в верхние слои и распыляется над сушей. Однако следует учитывать тот факт, что из сульфатов морского происхождения не может образовываться серная кислота, поэтому с точки зрения образования кислотных дождей они не имеют существенного значения. Их влияние сказывается лишь на регулировании образования облаков и осадков. Антропогенные источники эмиссии серы в атмосферу: В результате деятельности ...
... образованием угольной кислоты (H2CO3). Чистый дождь, проходящий через незагрязненный воздух, представляет собой водный раствор с pH 5,6 (к моменту удара о землю). Как мы увидим дальше, основная причина выпадения кислотных дождей — это деятельность человека, однако есть и естественные причины, начиная с извержения вулканов и разряда молнии и кончая жизнедеятельностью бактерий. В общем, даже если бы ...
... поверхности направлении ощущается увеличение скорости ветра и горизонтальное движение воздуха вызывает турбулентность. Таким путем компоненты воздуха достигают Земли, и наиболее активные кислотные вещества легко взаимодействуют с поверхностью. Влияние кислотных осадков на биосферу. Кислотные осадки оказывают вредное воздействие не только на отдельные предмет или живые существа, но и на их ...



0 комментариев