Навигация
Очищення води за допомогою озонування
Прогрес людства, розвиток культури і саме життя знаходяться в прямій залежності від запасів, збереження і використання води.
Загальні запаси води на земній кулі за оцінкою М.І. Львовича складають 1455 млн. км3, з них тільки 28 млн. км3, або близько 1,9 %, складають прісні води, дебіт яких катастрофічно знижується із-за наростаючого забруднення гідросфери неочищеними стічними водами. Решта вод — солоні, з різним ступенем мінералізації, непридатні без спеціальної обробки для промислового, сільськогосподарського і господарський-питного використання.
От чому охорона і раціональне використання водних ресурсів — одна з глобальних проблем сучасності.
Стрімкий розвиток науково-технічної революції, бурхливе зростання промисловості, транспорту, збільшення чисельності і урбанізація населення, хімізація сільськогосподарського виробництва — ці та інші чинники призводять до підвищеного використання природних ресурсів та діють на стан водного басейну.
Науково-технічна політика в області очищення природних вод на найближчу перспективу передбачає напрям зусиль численних науково-дослідних, проектно-конструкторських і технологічних організацій на подальшу розробку теоретичної бази хімії і технології води, впровадження нових технологічних процесів, створення сучасного водоочисного устаткування, приладів, засобів автоматизації, нових реагентів і матеріалів, що дозволяють підвищити продуктивність праці і економічність виробництва.
В наш час набуває популярності очистка води за допомогою озону. Ця тема вважається досить актуальною, адже має ряд переваг в порівнянні з іншими методами очистки.
Метою цієї роботи є дослідження процесу озонування води та знебарвлення забарвлених розчинів за допомогою озону.
1. Очищення води від органічних сполук
У природних водах до органічних домішок відносять гумусові речовини, що вимиваються з грунтів і торфянників, а також органічні речовини різних типів та їх з'єднання, у тому числі їхні комплекси з залізом.
Наявність у воді органічних речовин антропогенного походження становлять серйозну загрозу здоров'ю людини.
Останнім часом посилилося забруднення поверхневих і підземних джерел водопостачання речовинами антропогенного походження, до яких належать добрива і отрутохімікати, недостатньо очищені стічні води, що містять нафтопродукти, барвники, поверхнево-активні речовини та інші сполуки.
Очищення води від органічних забруднень як правило проводять двома методами:
1. Окислення (руйнування);
2. Сорбція (поглинання)
Очистку води від орагнічних забруднень в якості окислювачів використовують - хлор, озон, кисень, в деяких випадках перманганат калію.
Про чистку води від органічних забруднень також можна здійснювати сорбцією, коагуляцією і мембранними методами.
Окислювальний метод очищення води від органічних забруднень
Хлор є гарним дезинфіктантом і його бактерицидну дію проявляється по відношенню до бактерій і деяких видів вірусів. Знезаражуючий ефект залежить від дози хлору, час його контакту з водою та інших умов. У реакцію взаємодії з хлором можуть вступати різні хімічні сполуки.
Окислення хлором піддаються природні гумінові речовини, що обумовлюють кольоровість води. Є дані, що хлорування порушує стійкість колоїдних частинок водного гумусу, сприяючи їх коагуляції.
Мета прехлорування – попередня обробка води перед очисними спорудами для поліпшення або полегшення подальшого її очищення.
Прехлорування в разі погіршення якості води за бактеріологічними показниками, появи неприємних запахів присмаків повинно проводитися підвищеними дозами, відповідними точці перелому на кривій хлоропоглинанні, або великими. Вільний активний хлор в більшості випадків забезпечує значне поліпшення якості води за рахунок активного окислення органічних речовин.
Постхлорування використовується для знезараження води, яке є завершальним етапом очищення води. Постхлорування проводиться невеликими дозами, що забезпечують наявність залишкового хлору після резервуарів чистої води на рівні вимог ГОСТ 2874-82. надлишок хлору, недопустимий по гігієнічних міркуваннях, перед подачею води населенню має бути видалений.
Для дехлорування питної води використовують сірчистий газ SО2 (ГОСТ 2918) і гіпосульфіт натрію Na2S2O3 (ГОСТ 4215),а також гранульоване активоване вугілля і аміак NН3 (ГОСТ 6221). Витрати цих реагентів на 1 мг/л активного хлору наступні: SО2 – 0,9 мг/л; Na2S2O3 – 0,8-7,1 мг/л; NН3 – 0,13 мг/л.
Активоване вугілля 1,5-2,5 мм використовується як завантаження фільтрів шаром 2,5 м, швидкість фільтрування досягає 20-30 м/ч. Крім того, запропонований ряд комбінованих методів хлорування води: хлорування з амонізацією, хлорування з мангануванням, хлор-серебряний метод.
2. Хімічні властивості озону
Озон - безбарвний газ із сильним своєрідним запахом, токсичний, вибухонебезпечний, порівняно легко самовільно розкладається. У чистому і сухому повітрі розкладання його відбувається повільніше, ніж у вологому і забрудненому. Численними дослідженнями встановлено, що озон має високу бактерицидну дію. Крім того, відзначено більш сильну дію озону на спорові форми, а також і більш швидке знезаражуючі дії озону в порівнянні з хлором. Разом з тим обробка води озоном має свої особливості, які часто не дозволяють реалізувати його переваги як знезаражуючого реагенту. У зв'язку з цим у практиці іноді разом з обробкою води озоном перед подачею в мережу її піддають додатковому знезараженню хлором.
В останні роки зріс інтерес до озону як речовини, здатного видаляти з води органічні забруднення. Згідно з даними ряду авторів, окилювальну дію озону на органічні речовини може протікати в різних формах: безпосереднє окислення шляхом втрати атома кисню, а також шляхом впровадження молекулярного озону в молекулу речовини (озоналіз); каталітичну дію, збільшуючи окисну роль кисню, що міститься в озонованому повітрі.
В результаті окислення також утворюються шкідливі речовини, які необхідно видаляти, що призводить до ускладнення технологічного процесу і збільшує вартість очищення води.
Озон - це нестійкий трьохатомний кисень, що володіє сильними знезаражувальними властивостями і що є сильним окислювачем. Озон руйнує органічні сполуки і мікроорганізми, при цьому розкладаючись на кисень.
О3 = О2 + О – 100,56 кДж; (2.1)
О + О3 = 2О2 + 398,05 кДж; (2.2)
Сумарна реакція:
2О2 = 3О2 + 297,49 кДж. (2.3)
Озон — алотропна модифікація кисню (О3). В нижніх шарах атмосфери його вміст незначний. Найбільша його концентрація в стратосфері між висотами 10 і 40 км. Озон значно поглинає ультрафіолетову радіацію.
Проста речовина, алотропна видозміна кисню. Хімічно-активний газ синього кольору з різким запахом, сильний окиснювач. При великих концентраціях розкладається з вибухом. Утворюється з кисню при електричному розряді (наприклад, під час грози). Основна маса озону знаходиться у верхньому шарі атмосфери — озоносфері, на висоті від 10 до 50 км із максимумом концентрації на висоті 20-25 км. Цей шар охороняє живі організми Землі від шкідливого впливу короткохвильової ультрафіолетової радіації Сонця (може викликати рак шкіри). Зараз під впливом хлорфторвуглеців цей шар руйнується, що може негативно вплинути на жителів Землі. У багатьох країнах використання таких речовин, що входять у різні аерозолі, заборонено. У промисловості озон одержують під дією на повітря електричного заряду, його використовують, зокрема, для знезаражування води і повітря.
Температура кипіння озону −112 °C; вага 1 л — 2,14 г. Утворює озоніди (сполуки лужних металів і амонію, які містять аніони О3-). Легко розкладається (О3 → О + О2). Вміст у повітрі: влітку — до 7•10-6% об'ємних, взимку — 2•10-6%. На висоті 20-25 км знаходиться прошарок в атмосфері Землі, де концентрація озону найбільша (так званий озоновий прошарок). Саме він захищає Землю від ультрафіолетового випромінювання космосу. У другій половині ХХ ст. зафіксована тенденція до потоншання цього прошарку і навіть утворення «озонових дірок» — областей зі зниженою концентрацією озону в озоновому прошарку. Це явище пов'язують із антропогенним забрудненням атмосфери, зокрема фреонами. Озон утворюється при дії електричного розряду або ультрафіолетового випромінювання на повітря. Використовується у хімічному синтезі, для стерилізації води, для дезинфекції й дезодорації повітря, вибілювання тканин, паперу, мінеральних масел тощо. Бактерицидний засіб. Є мутагеном. Гранично допустима концентрація у повітрі — 1 мг/м3.
Озон має дуже високу окислювальну здатність (Е0=+2,07 В; в лужному середовищі Е0=1,24 В) і за нормальної температури руйнує багато органічних сполук. Під час озонування одночасно відбувається окиснення домішок, знебарвлення, дезодорація, знезараження стічної води та насичення її киснем.
Молекула озону триатомна й має трикутну будову (рисунок.2.1).
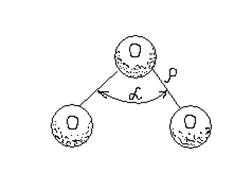
Рисунок 2.1 Будова молекули озону
За тиску 0,1 МПа і 0оС в 1 дм3 води розчиняється 1,42 г озону, при 10 оС—1,04 г, при 30 оС—0,45 г. Розчинність озону у воді залежить від величини рН та кількості домішок у воді. За наявності кислот і солей розчинність озону у воді зростає, за наявності лугів – зменшується. Озон дисоціює на повітрі та у водному розчині, перетворюючись на оксиген. У водному розчині озон дисоціює швидше. Розкладання озону у воді різко зростає в разі підвищення рН та температури. Стійкість озону в нейтральному та кислому середовищах пов’язана з утворенням асоціатів НО3+, гідратна оболонка яких уповільнює реакцію:
О3 + Н2О = О2 + О + Н2О (2.4)
Розкладання озону у воді прискорюється за наявності активованого вугілля, металів змінної валентності (мангану, кобальту, феруму) деяких оксидів (Р2О5), пероксиду барію (ВаО2). Такі матеріали, як фторо- та хлоровмісні пластмаси, скло, деякі матеріали, не вливають на стійкість озону.
В основу промислового одержання озону покладено реакцію розщеплення молекули кисню на атоми під дією тихого або бар’єрного розряду. Висока реакційна здатність озону зумовлена великою надлишковою енергією молекули:
О3 = 3/2 О2 + 100 кДж/моль (2.5)
Озон реагує з насиченими органічними сполуками з утворенням вільних радикалів. Лімітуючою стадією процесу є вплив озону на зв'язок С-Н
RH + O3 = R. + HO. + O2 ( або R + HO.3). (2.6)
Радикали R., які утворилися в атмосфері оксисену, переважно перетворюються на пероксид радикали помірної активності. Тому ланцюгова реакція окиснення може виникнути лише за достатньо високої температури, коли швидкість реакції зростання ланцюга перевищує реакцію його обірванця. За невисокої температури окиснення озоном відбувається як не ланцюгова реакція з утворенням гілроксигідропероксидів:
R. + О2 = RО2.; (2.7)
RО2. + RH = RООH + R.. (2.8)
Альдегіди в свою чергу, окислюються до надто кислот, які розкладаються в розбавлених водних розчинах до органічних кислот та пероксиду гідрогену. Паралельно може відбуватися реакція окиснення гідроксильного радикалу:
HO. + O3 = HO2. + O2 (2.9)
з наступною комбінацією пероксид радикалів:
2HO2. = Н2О2 + O2. (2.10)
Проте насправді пероксид гідрогену не накопичується і витрата озону в нейтральному та кислому середовищах відповідає реакції
R-CH2OH + 2O3 = RCOOH + 2O2 + H2O. (2.11)
Мабуть, у момент виділення пероксид гідрогену реагує з озоном:
H2O2 + O3 = H2O + 2O2. (2.12)
Крім того, можливо, що озон витрачається на розкладання гідрокси – гідроксипероксидів та надкислот. Швидкість реакції за цих умов зростає, що, ймовірно, зумовлено розкладання пероксид гідрогену, гідропероксиду, надкислоти та озону. Одночасне збільшення кількості генерованих первинних радикалів ініціює процес окиснення. Отже для прискорення процесу ініціювання процес окиснення озоном доцільно проводити в лужному середовищі. Для більшості органічних сполук проміжними та кінцевими продуктами окиснення є спирти, альдегіди(кетони) та кислоти [1].
Озон утворюється з кисню. Його синтез може бути здійснений різними методами; найбільш поширеними є: електролітичний, хімічний, фотохімічний і електросинтез. Крім того, озон отримують при іонізуючих випромінюваннях.
1. Електролітичний метод. Синтезу озону відомий давно. Механізм же утворення озону в електролітичних процесах до теперішнього часу до кінця ще не вивчений.
Синтез озону здійснюють в спеціальних комірках, в ролі електролітів використовують розчини різних кислот (H2SO4, НС1О4) або їх солі (NaClO4> КСlO4 і ін.) Кислоти або їх солі, що беруть участь в реакціях електролізу, не віддають свого кисню, а при утворенні озону відбувається розкладання іонів і радикалів:
Н2О+О2 = Оз+2Н+ +2е (2.10)
Електролітичним способом можна отримати концентрований озон (30—58%-ний), наприклад при електролізі 40%-ній оксихлоридный кислоти з охолодженими до —65° З платиновими анодами; середня температура електроліту повинна наближатися до температури замерзання (—56° С). Густина струму на аноді —0,13— 2,16 А/дм2, напруга —8—13 В, загальний тиск над електролітом — в межах 10—100 мм рт. ст. При електролізі розчинів солей утворення озону йде ефективніше, ніж при електролізі розчинів кислот, сам процес стабільніший, максимальний вихід по струму озону досягається за мінімальний час (10 хв), переривання струму не змінює синтезу озону [2].
2. Фотохімічне утворення озону відбувається в основному в природних умовах за рахунок дії сонячної радіації. Проте фотохімічно неможливо отримати озон у високих концентраціях. Основна область фотохімічного здобуття озону в малих концентраціях — це лабораторна практика (вивчення біологічної дії озону, випробування гум, клеїв, озонування повітря у виробничих приміщеннях і ін.).
На практиці озон отримують в спеціальних апаратах – озонаторах, в яких повітря з певною швидкістю пропускається між двома електродами, що з’єднані з джерелом живлення (5 – 20 кВ) [6]. Конструктивно електроди виконані у вигляді двох концентрично розміщених циліндрів різного діаметру (рисунок2.2) або у вигляді двох паралельних пластин (рисунок 2.3).
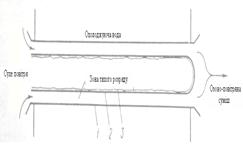
Рисунок 2.2 Розміщення електродів та діалектрика в трубчастому озонаторі
1 – трубка з нержавіючої сталі( електрод низької напруги; 2 – склянна трубка;
3 – фольга( електрод високої напруги).
Для отримання тихого розряду електроди озонаторів розділюють діалектриком с максимально можливим гранично поверхневим опором і
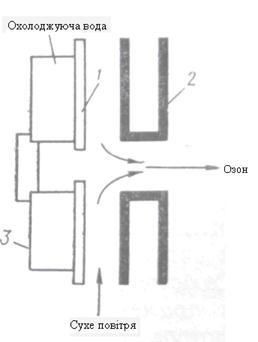
Рисунок 2.3 Розміщення електродів та діалектрика в пластинчастому озонаторі
1 – пластинка звичайного скла (діалектрик); 2 – профільні пластинки; 3 – пола пластинка із листового алюмінію
Для отримання тихого розряду електроди озонаторів розділюють діалектриком с максимально можливим гранично поверхневим опором і діалектричною сталою. Шар такого матеріалу слугує діалектричним бар’єром, що виключає отримання іскрового чи дугового розряду та обумовлює рівномірну структуру тихого розкладу. Одночасно він слугує реактивним буферним опором, що обмежує струм в ланцюгу розряду. В якості діалектриків використовуються звичайне або боросилікатне скло, емаль, пластмаси.
В зв’язку з тим, що 85 – 95% енергії, яку споживає озонатор затрачається на тепловиділення, електродну систему необхідно охолоджувати, бо озон при підвищеній температурі швидко розкладається. Основною величиною, що визначає синтез озону, слугує потужність розряду, віднесена до витрати газу, тобто, кількість енергії, що приходиться на об’єм пропущеного через озонатор газу.
Похожие работы
... ”. Вона має значно більшу мінералізацію, твердість, погіршені смакові якості, у деяких районах вода має запах нафти. 1.2. Якісна характеристика води на Херсонщині. Однією з найболючіших проблем області є стан питних вод. Саме цей фактор серйозно впливає на здоров’я населення області, зокрема, на сольовий баланс системи травлення, появу злоякісних пухлин, порушує діяльність кровотворної, ...
... вмісту марганцю не спостерігалось. Порівнюючи з минулим роками (1998-2000р) стан річок Случ, Уж, Гнилоп’ять, Гуйва, Ірша, Роставиця, Кам’янка і Ірпінь залишився стабільним. Спостерігається покращення якості води в річках Норинь і Уборть. Крім цього проводився моніторинг поверхневих вод області ще на 5-ти основних водозаборах області – це р. Тетерів (водосховище “Відсічне”, вище м. Житомира), р. ...
... та водовідведення Дніпропетровської області. Розкрито шляхи подолання існуючих екологічних проблем цього регіону та пріоритети майбутнього удосконалення систем водоспоживання та водовідведення. Розділ 3. Екологічні проблеми водоспоживання та водовідведення та шляхи їх подолання 3.1 Методики фільтрації води та їх використання при водоспоживанні та водовідведенні 3.1.1 Фільтрування Фі ...
... лакмус. Вода спочатку пропускається через колонку з катіонітом, а потім - з аніонітом чи у зворотному порядку (конвекційна система), або ж воду пропускають через одну колонку, що містить одночасно катіоніт і аніоніт (змішана колонка). В аптечній практиці може бути використаний демінералізатор, що містить катіонітну й аніонітну іонообмінні колонки, датчик контролю електроопору знесоленої води і ...

0 комментариев