При прогнозировании энтропий органических веществ, находящихся при давлении 1 атм и температуре, отличающейся от 298 К, используются:
* значение ![]() вещества, вычисленное любым из аддитивных методов или взятое из справочников;
вещества, вычисленное любым из аддитивных методов или взятое из справочников;
* сведения о температурной зависимости теплоемкости вещества в виде аппроксимирующего уравнения или в табулированной форме;
* уравнение (2.4) для расчета температурной зависимости энтропии.
Процедура расчета иллюстрируется примером 2.4, при этом использованы справочные данные для теплоемкостей вещества, поскольку вопросы прогнозирования ![]() обсуждаются позже (разд. 3 данного пособия).
обсуждаются позже (разд. 3 данного пособия).
Пример: Рассчитать ![]() окиси этилена при 400, 500 и 600 К. Энтропия
окиси этилена при 400, 500 и 600 К. Энтропия ![]() окиси этилена составляет 242,4 Дж/(моль×К) [1], значения теплоемкостей C0p,T при 400, 500 и 600 К заимствованы из [1] и приведены в табл. 2.6.
окиси этилена составляет 242,4 Дж/(моль×К) [1], значения теплоемкостей C0p,T при 400, 500 и 600 К заимствованы из [1] и приведены в табл. 2.6.
Решение: С использованием уравнения (2.4) вычисляются энтропиии окиси этилена при интересующих температурах. При этом средние величины теплоемкостей окиси этилена считаются величинами постоянными для каждого из температурных диапазонов (от 300 до 400, от 400 до 500 и от 500 до 600 К) по условию создания таблиц, допускающему линейную интерполяцию соседних значений в них.
Результаты расчета приведены ниже и в табл. 2.6 сопоставлены с рекомендуемыми значениями [1].
![]() = 242,74+(48,53+62,55)/2·(ln400 – ln300) = 258,72 Дж/(моль×К);
= 242,74+(48,53+62,55)/2·(ln400 – ln300) = 258,72 Дж/(моль×К);
![]() = 258,72+(62,55+75,44)/2·(ln500 – ln400) = 274,12 Дж/(моль×К);
= 258,72+(62,55+75,44)/2·(ln500 – ln400) = 274,12 Дж/(моль×К);
![]() = 274,12 +(75,44+86,27)/2·(ln600 – ln500) = 288,86 Дж/(моль×К).
= 274,12 +(75,44+86,27)/2·(ln600 – ln500) = 288,86 Дж/(моль×К).
Температурная зависимость ![]() иллюстрируется рис. 2.1.
иллюстрируется рис. 2.1.
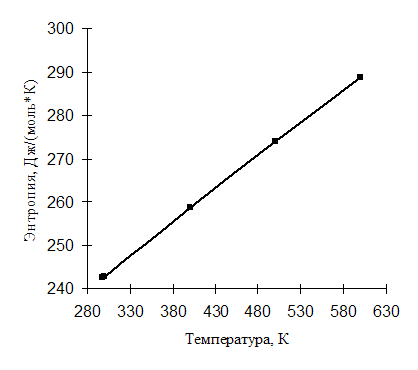
Рис. 2.1. Зависимость идеально-газовой энтропии окиси этилена от температуры
Таблица 2.6
| Т, К |
|
|
| Погрешность, % отн. |
| 298 | 242,42 | 48,28 | ||
| 300 | 242,76 | 48,53 | 242,74 | 0,00 |
| 400 | 258,65 | 62,55 | 258,72 | 0,03 |
| 500 | 274,01 | 75,44 | 274,12 | 0,04 |
| 600 | 288,78 | 86,27 | 288,86 | 0,03 |
Прогнозирование энтропий органических соединений при повышенных давлениях
При прогнозировании энтропий веществ при повышенных давлениях широко используется подход, аналогичный рассмотренному выше для энтальпий образования (разд. 1) и основанный на принципе соответственных состояний и разложении Питцера для энтропии:
 (2.11)
(2.11)
и таблицах Ли-Кеслера (табл. 2.7, 2.8) для энтропии.
В уравнении (2.11) - ацентрический фактор; 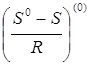 - поправка к энтропии на давление, характеризующая поведение простого вещества;
- поправка к энтропии на давление, характеризующая поведение простого вещества;  - функция отклонения в поведении рассматриваемого вещества от поведения простого вещества;
- функция отклонения в поведении рассматриваемого вещества от поведения простого вещества; ![]() - идеально-газовая энтропия вещества при рассматриваемой температуре,
- идеально-газовая энтропия вещества при рассматриваемой температуре, ![]() - искомая энтропия, R - газовая постоянная, равная 8,31441 Дж/(моль×К) или 1,98725 кал/(моль×К);
- искомая энтропия, R - газовая постоянная, равная 8,31441 Дж/(моль×К) или 1,98725 кал/(моль×К); ![]() - стандартное давление (1 атм, 101325 Па и пр.),
- стандартное давление (1 атм, 101325 Па и пр.), ![]() - интересующее давление, для которого производится расчет энтропии, выраженное в тех же единицах, что и стандартное давление.
- интересующее давление, для которого производится расчет энтропии, выраженное в тех же единицах, что и стандартное давление.
Таблицы Ли-Кеслера, как и для энтальпий (разд. 1), составлены на основе достаточно универсального уравнения состояния вещества (уравнение Бенедикта-Уэбба-Рубина) с соблюдением общепринятых принципов, т.е. между любыми соседними значениями в столбцах или строках таблицы корректной является линейная интерполяция. В таблицах область, лежащая выше ломаной линии, принадлежит жидкому состоянию вещества.
Расчет ![]() иллюстрируется примером 2.5.
иллюстрируется примером 2.5.
Пример 2.5
Рассчитать ![]() окиси этилена при давлении, изменяющемся от 0,71 до 142 атм., и при температурах 304,85, 422,10, 492,45 и 562,80 К.
окиси этилена при давлении, изменяющемся от 0,71 до 142 атм., и при температурах 304,85, 422,10, 492,45 и 562,80 К.
Изотермические изменения энтропии, рассчитанные по уравнению
Значения для простого вещества 
| Tr | Pr | ||||||
| 0,010 | 0,050 | 0,100 | 0,200 | 0,400 | 0,600 | 0,800 | |
| 0,30 | 11,614 | 10,008 | 9,319 | 8,635 | 7,961 | 7,574 | 7,304 |
| 0,35 | 11,185 | 9,579 | 8,890 | 8,205 | 7,529 | 7,140 | 6,869 |
| 0,40 | 10,802 | 9,196 | 8,506 | 7,821 | 7,144 | 6,755 | 6,483 |
| 0,45 | 10,453 | 8,847 | 8,157 | 7,472 | 6,794 | 6,404 | 6,132 |
| 0,50 | 10,137 | 8,531 | 7,841 | 7,156 | 6,479 | 6,089 | 5,816 |
| 0,55 | 0,038 | 8,245 | 7,555 | 6,870 | 6,193 | 5,803 | 5,531 |
| 0,60 | 0,029 | 7,983 | 7,294 | 6,610 | 5,933 | 5,544 | 5,273 |
| 0,65 | 0,023 | 0,122 | 7,052 | 6,368 | 5,694 | 5,306 | 5,036 |
| 0,70 | 0,018 | 0,096 | 0,206 | 6,140 | 5,467 | 5,082 | 4,814 |
| 0,75 | 0,015 | 0,078 | 0,164 | 5,917 | 5,248 | 4,866 | 4,600 |
| 0,80 | 0,013 | 0,064 | 0,134 | 0,294 | 5,026 | 4,649 | 4,388 |
| 0,85 | 0,011 | 0,054 | 0,111 | 0,239 | 4,785 | 4,418 | 4,166 |
| 0,90 | 0,009 | 0,046 | 0,094 | 0,199 | 0,463 | 4,145 | 3,912 |
| 0,93 | 0,008 | 0,042 | 0,085 | 0,179 | 0,408 | 0,750 | 3,723 |
| 0,95 | 0,008 | 0,039 | 0,080 | 0,168 | 0,377 | 0,671 | 3,556 |
| 0,97 | 0,007 | 0,037 | 0,075 | 0,157 | 0,350 | 0,607 | 1,056 |
| 0,98 | 0,007 | 0,036 | 0,073 | 0,153 | 0,337 | 0,580 | 0,971 |
| 0,99 | 0,007 | 0,035 | 0,071 | 0,148 | 0,326 | 0,555 | 0,903 |
| 1,00 | 0,007 | 0,034 | 0,069 | 0,144 | 0,315 | 0,532 | 0,847 |
| 1,01 | 0,007 | 0,033 | 0,067 | 0,139 | 0,304 | 0,510 | 0,799 |
| 1,02 | 0,006 | 0,032 | 0,065 | 0,135 | 0,294 | 0,491 | 0,757 |
| 1,05 | 0,006 | 0,030 | 0,060 | 0,124 | 0,267 | 0,439 | 0,656 |
| 1,10 | 0,005 | 0,026 | 0,053 | 0,108 | 0,230 | 0,371 | 0,537 |
| 1,15 | 0,005 | 0,023 | 0,047 | 0,096 | 0,201 | 0,319 | 0,452 |
| 1,20 | 0,004 | 0,021 | 0,072 | 0,085 | 0,177 | 0,277 | 0,389 |
| 1,30 | 0,003 | 0,017 | 0,033 | 0,068 | 0,140 | 0,217 | 0,298 |
| 1,40 | 0,003 | 0,014 | 0,027 | 0,056 | 0,114 | 0,174 | 0,237 |
| 1,50 | 0,002 | 0,011 | 0,023 | 0,046 | 0,094 | 0,143 | 0,194 |
| 1,60 | 0,002 | 0,010 | 0,019 | 0,039 | 0,079 | 0,120 | 0,168 |
| 1,70 | 0,002 | 0,008 | 0,017 | 0,033 | 0,067 | 0,102 | 0,137 |
| 1,80 | 0,001 | 0,007 | 0,014 | 0,029 | 0,058 | 0,088 | 0,117 |
| 1,90 | 0,001 | 0,006 | 0,013 | 0,025 | 0,051 | 0,076 | 0,102 |
| 2,00 | 0,001 | 0,006 | 0,011 | 0,022 | 0,044 | 0,067 | 0,089 |
| 2,20 | 0,001 | 0,004 | 0,009 | 0,018 | 0,035 | 0,053 | 0,070 |
| 2,40 | 0,001 | 0,004 | 0,007 | 0,014 | 0,028 | 0,042 | 0,056 |
| 2,60 | 0,001 | 0,003 | 0,006 | 0,012 | 0,023 | 0,035 | 0,046 |
| 2,80 | 0,000 | 0,002 | 0,005 | 0,010 | 0,020 | 0,029 | 0,039 |
| 3,00 | 0,000 | 0,002 | 0,004 | 0,008 | 0,017 | 0,025 | 0,033 |
| 3,50 | 0,000 | 0,001 | 0,003 | 0,006 | 0,012 | 0,017 | 0,023 |
| 4,00 | 0,000 | 0,001 | 0,002 | 0,004 | 0,009 | 0,013 | 0,017 |
Таблица 2.7
Состояния Ли-Кеслера
| Pr | |||||||
| 1,000 | 1,200 | 1,500 | 2,000 | 3,000 | 5,000 | 7,000 | 10,000 |
| 7,099 | 6,935 | 6,740 | 6,497 | 6,182 | 5,847 | 5,683 | 5,578 |
| 6,663 | 6,497 | 6,299 | 6,052 | 5,728 | 5,376 | 5,194 | 5,060 |
| 6,275 | 6,109 | 5,909 | 5,660 | 5,330 | 4,967 | 4,772 | 4,619 |
| 5,924 | 5,757 | 5,557 | 5,306 | 4,974 | 4,603 | 4,401 | 4,234 |
| 5,608 | 5,441 | 5,240 | 4,989 | 4,656 | 4,282 | 4,074 | 3,899 |
| 5,324 | 5,157 | 4,956 | 4,706 | 4,373 | 3,998 | 3,788 | 3,607 |
| 5,066 | 4,900 | 4,700 | 4,451 | 4,120 | 3,747 | 3,537 | 3,353 |
| 4,830 | 4,665 | 4,467 | 4,220 | 3,892 | 3,523 | 3,315 | 3,131 |
| 4,610 | 4,446 | 4,250 | 4,007 | 3,684 | 3,322 | 3,117 | 2,935 |
| 4,399 | 4,238 | 4,045 | 3,807 | 3,491 | 3,138 | 2,939 | 2,761 |
| 4,191 | 4,034 | 3,846 | 3,615 | 3,310 | 2,970 | 2,777 | 2,605 |
| 3,976 | 3,825 | 3,646 | 3,425 | 3,135 | 2,812 | 2,629 | 2,463 |
| 3,738 | 3,599 | 3,434 | 3,231 | 2,964 | 2,663 | 2,491 | 2,334 |
| 3,569 | 3,444 | 3,295 | 3,108 | 2,860 | 2,577 | 2,412 | 2,262 |
| 3,433 | 3,326 | 3,193 | 3,023 | 2,790 | 2,520 | 2,362 | 2,215 |
| 3,259 | 3,188 | 3,081 | 2,932 | 2,719 | 2,463 | 2,312 | 2,170 |
| 3,142 | 3,106 | 3,019 | 2,884 | 2,682 | 2,436 | 2,287 | 2,148 |
| 2,972 | 3,010 | 2,953 | 2,835 | 2,646 | 2,408 | 2,263 | 2,126 |
| 2,178 | 2,893 | 2,879 | 2,784 | 2,609 | 2,380 | 2,239 | 2,105 |
| 1,391 | 2,736 | 2,798 | 2,730 | 2,571 | 2,352 | 2,215 | 2,083 |
| 1,225 | 2,495 | 2,706 | 2,673 | 2,533 | 2,325 | 2,191 | 2,062 |
| 0,965 | 1,523 | 2,328 | 2,483 | 2,415 | 2,242 | 2,121 | 2,001 |
| 0,742 | 1,012 | 1,557 | 2,081 | 2,202 | 2,104 | 2,007 | 1,903 |
| 0,607 | 0,790 | 1,126 | 1,649 | 1,968 | 1,966 | 1,897 | 1,810 |
| 0,512 | 0,651 | 0,890 | 1,308 | 1,727 | 1,827 | 1,789 | 1,722 |
| 0,385 | 0,478 | 0,628 | 0,891 | 1,299 | 1,554 | 1,581 | 1,556 |
| 0,303 | 0,372 | 0,478 | 0,663 | 0,990 | 1,303 | 1,386 | 1,402 |
| 0,246 | 0,299 | 0,381 | 0,520 | 0,777 | 1,088 | 1,208 | 1,260 |
| 0,204 | 0,247 | 0,312 | 0,421 | 0,628 | 0,913 | 1,050 | 1,130 |
| 0,172 | 0,208 | 0,261 | 0,350 | 0,519 | 0,773 | 0,915 | 1,013 |
| 0,147 | 0,177 | 0,222 | 0,296 | 0,438 | 0,661 | 0,799 | 0,908 |
| 0,127 | 0,153 | 0,191 | 0,255 | 0,375 | 0,570 | 0,702 | 0,815 |
| 0,111 | 0,134 | 0,167 | 0,221 | 0,325 | 0,497 | 0,620 | 0,733 |
| 0,087 | 0,105 | 0,130 | 0,172 | 0,251 | 0,388 | 0,492 | 0,599 |
| 0,070 | 0,084 | 0,104 | 0,138 | 0,201 | 0,311 | 0,399 | 0,496 |
| 0,058 | 0,069 | 0,086 | 0,113 | 0,164 | 0,255 | 0,329 | 0,416 |
| 0,048 | 0,580 | 0,072 | 0,094 | 0,137 | 0,213 | 0,277 | 0,353 |
| 0,041 | 0,049 | 0,061 | 0,080 | 0,116 | 0,181 | 0,236 | 0,303 |
| 0,029 | 0,034 | 0,042 | 0,056 | 0,081 | 0,126 | 0,166 | 0,216 |
| 0,021 | 0,025 | 0,031 | 0,041 | 0,059 | 0,093 | 0,123 | 0,162 |
Изотермические изменения энтропии, рассчитанные по уравнению
Значения для простого вещества 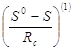
| Tr | Pr | ||||||
| 0,010 | 0,050 | 0,100 | 0,200 | 0,400 | 0,600 | 0,800 | |
| 0,30 | 16,782 | 16,774 | 16,764 | 16,744 | 16,705 | 16,665 | 16,626 |
| 0,35 | 15,413 | 15,408 | 15,401 | 15,387 | 15,359 | 15,333 | 15,305 |
| 0,40 | 13,990 | 13,986 | 13,981 | 13,972 | 13,953 | 13,934 | 13,915 |
| 0,45 | 12,564 | 12,561 | 12,558 | 12,551 | 12,537 | 12,523 | 12,509 |
| 0,50 | 11,202 | 11,200 | 11,197 | 11,192 | 11,182 | 11,172 | 11,162 |
| 0,55 | 0,115 | 9,948 | 9,946 | 9,942 | 9,935 | 9,928 | 9,921 |
| 0,60 | 0,078 | 8,828 | 8,826 | 8,823 | 8,817 | 8,811 | 8,806 |
| 0,65 | 0,055 | 0,309 | 7,832 | 7,829 | 7,824 | 7,819 | 7,815 |
| 0,70 | 0,040 | 0,216 | 0,491 | 6,951 | 6,945 | 6,941 | 6,937 |
| 0,75 | 0,029 | 0,156 | 0,340 | 6,173 | 6,167 | 6,162 | 6,158 |
| 0,80 | 0,022 | 0,116 | 0,246 | 0,578 | 5,475 | 5,468 | 5,462 |
| 0,85 | 0,017 | 0,088 | 0,183 | 0,408 | 4,853 | 4,841 | 4,832 |
| 0,90 | 0,013 | 0,068 | 0,140 | 0,301 | 0,744 | 4,269 | 4,249 |
| 0,93 | 0,011 | 0,058 | 0,120 | 0,254 | 0,593 | 1,219 | 3,914 |
| 0,95 | 0,010 | 0,053 | 0,109 | 0,228 | 0,517 | 0,961 | 3,697 |
| 0,97 | 0,010 | 0,048 | 0,099 | 0,206 | 0,456 | 0,797 | 1,570 |
| 0,98 | 0,009 | 0,046 | 0,094 | 0,196 | 0,429 | 0,734 | 1,270 |
| 0,99 | 0,009 | 0,044 | 0,090 | 0,186 | 0,405 | 0,680 | 1,098 |
| 1,00 | 0,008 | 0,042 | 0,086 | 0,177 | 0,382 | 0,632 | 0,977 |
| 1,01 | 0,008 | 0,040 | 0,082 | 0,169 | 0,361 | 0,590 | 0,883 |
| 1,02 | 0,008 | 0,039 | 0,078 | 0,161 | 0,342 | 0,552 | 0,807 |
| 1,05 | 0,007 | 0,034 | 0,069 | 0,140 | 0,292 | 0,460 | 0,642 |
| 1,10 | 0,005 | 0,028 | 0,055 | 0,112 | 0,229 | 0,350 | 0,470 |
| 1,15 | 0,005 | 0,023 | 0,045 | 0,091 | 0,183 | 0,275 | 0,361 |
| 1,20 | 0,004 | 0,019 | 0,037 | 0,075 | 0,149 | 0,220 | 0,286 |
| 1,30 | 0,003 | 0,013 | 0,026 | 0,052 | 0,102 | 0,148 | 0,190 |
| 1,40 | 0,002 | 0,010 | 0,019 | 0,037 | 0,072 | 0,104 | 0,133 |
| 1,50 | 0,001 | 0,007 | 0,014 | 0,027 | 0,053 | 0,076 | 0,097 |
| 1,60 | 0,001 | 0,005 | 0,011 | 0,021 | 0,040 | 0,057 | 0,073 |
| 1,70 | 0,001 | 0,004 | 0,008 | 0,016 | 0,031 | 0,044 | 0,056 |
| 1,80 | 0,001 | 0,003 | 0,006 | 0,013 | 0,024 | 0,035 | 0,044 |
| 1,90 | 0,001 | 0,003 | 0,005 | 0,010 | 0,019 | 0,028 | 0,036 |
| 2,00 | 0,000 | 0,002 | 0,004 | 0,008 | 0,016 | 0,023 | 0,029 |
| 2,20 | 0,000 | 0,001 | 0,003 | 0,006 | 0,011 | 0,016 | 0,021 |
| 2,40 | 0,000 | 0,001 | 0,002 | 0,004 | 0,008 | 0,012 | 0,015 |
| 2,60 | 0,000 | 0,001 | 0,002 | 0,003 | 0,006 | 0,009 | 0,012 |
| 2,80 | 0,000 | 0,001 | 0,001 | 0,003 | 0,005 | 0,008 | 0,010 |
| 3,00 | 0,000 | 0,001 | 0,001 | 0,002 | 0,004 | 0,006 | 0,008 |
| 3,50 | 0,000 | 0,000 | 0,001 | 0,001 | 0,003 | 0,004 | 0,006 |
| 4,00 | 0,000 | 0,000 | 0,001 | 0,001 | 0,002 | 0,003 | 0,005 |
Таблица 2.8
Состояния Ли-Кеслера
| Pr | |||||||
| 1,000 | 1,200 | 1,500 | 2,000 | 3,000 | 5,000 | 7,000 | 10,000 |
| 16,586 | 16,547 | 16,488 | 16,390 | 16,195 | 15,837 | 15,468 | 14,925 |
| 15,278 | 15,251 | 15,211 | 15,144 | 15,011 | 14,751 | 14,496 | 14,153 |
| 13,896 | 13,877 | 13,849 | 13,803 | 13,714 | 13,541 | 13,376 | 13,144 |
| 12,496 | 12,482 | 12,462 | 12,430 | 12,367 | 12,248 | 12,145 | 11,999 |
| 11,153 | 11,143 | 11,129 | 11,107 | 11,063 | 10,985 | 10,920 | 10,836 |
| 9,914 | 9,907 | 9,897 | 9,882 | 9,853 | 9,806 | 9,769 | 9,732 |
| 8,799 | 8,794 | 8,787 | 8,777 | 8,760 | 8,736 | 8,723 | 8,720 |
| 7,810 | 7,807 | 7,801 | 7,794 | 7,784 | 7,779 | 7,785 | 7,811 |
| 6,933 | 6,930 | 6,926 | 6,922 | 6,919 | 6,929 | 6,952 | 7,002 |
| 6,155 | 6,152 | 6,149 | 6,147 | 6,149 | 6,174 | 6,213 | 6,285 |
| 5,458 | 5,455 | 5,453 | 5,452 | 5,461 | 5,501 | 5,555 | 5,648 |
| 4,826 | 4,822 | 4,820 | 4,822 | 4,839 | 4,898 | 4,969 | 5,082 |
| 4,238 | 4,232 | 4,230 | 4,236 | 4,267 | 4,351 | 4,442 | 4,578 |
| 3,894 | 3,885 | 3,884 | 3,896 | 3,941 | 4,046 | 4,151 | 4,300 |
| 3,658 | 3,647 | 3,648 | 3,669 | 3,728 | 3,851 | 3,966 | 4,125 |
| 3,406 | 3,391 | 3,401 | 3,437 | 3,517 | 3,661 | 3,788 | 3,957 |
| 3,264 | 3,247 | 3,268 | 3,318 | 3,412 | 3,569 | 3,701 | 3,875 |
| 3,093 | 3,082 | 3,126 | 3,195 | 3,306 | 3,477 | 3,616 | 3,796 |
| 2,399 | 2,868 | 2,967 | 3,067 | 3,200 | 3,387 | 3,532 | 3,717 |
| 1,306 | 2,513 | 2,784 | 2,933 | 3,094 | 3,297 | 3,450 | 3,640 |
| 1,113 | 1,655 | 2,557 | 2,790 | 2,986 | 3,209 | 3,369 | 3,565 |
| 0,820 | 0,831 | 1,443 | 2,283 | 2,655 | 2,949 | 3,134 | 3,348 |
| 0,577 | 0,640 | 0,618 | 1,241 | 2,067 | 2,534 | 2,767 | 3,013 |
| 0,437 | 0,489 | 0,502 | 0,654 | 1,471 | 2,138 | 2,428 | 2,708 |
| 0,343 | 0,385 | 0,412 | 0,447 | 0,991 | 1,767 | 2,115 | 2,430 |
| 0,226 | 0,254 | 0,282 | 0,300 | 0,481 | 1,147 | 1,569 | 1,944 |
| 0,158 | 0,178 | 0,200 | 0,220 | 0,290 | 0,730 | 1,138 | 1,544 |
| 0,115 | 0,130 | 0,147 | 0,166 | 0,206 | 0,479 | 0,823 | 1,222 |
| 0,086 | 0,098 | 0,112 | 0,129 | 0,159 | 0,334 | 0,604 | 0,969 |
| 0,067 | 0,076 | 0,087 | 0,102 | 0,127 | 0,248 | 0,456 | 0,775 |
| 0,053 | 0,060 | 0,070 | 0,083 | 0,105 | 0,195 | 0,355 | 0,628 |
| 0,043 | 0,049 | 0,057 | 0,069 | 0,089 | 0,160 | 0,286 | 0,518 |
| 0,035 | 0,040 | 0,048 | 0,058 | 0,077 | 0,136 | 0,238 | 0,434 |
| 0,025 | 0,029 | 0,035 | 0,043 | 0,060 | 0,105 | 0,178 | 0,322 |
| 0,019 | 0,022 | 0,027 | 0,034 | 0,048 | 0,086 | 0,143 | 0,254 |
| 0,015 | 0,018 | 0,021 | 0,028 | 0,041 | 0,074 | 0,120 | 0,210 |
| 0,012 | 0,014 | 0,018 | 0,023 | 0,035 | 0,065 | 0,104 | 0,180 |
| 0,010 | 0,012 | 0,015 | 0,020 | 0,031 | 0,058 | 0,093 | 0,158 |
| 0,007 | 0,009 | 0,011 | 0,015 | 0,024 | 0,046 | 0,073 | 0,122 |
| 0,006 | 0,007 | 0,009 | 0,012 | 0,020 | 0,038 | 0,060 | 0,100 |
Одной из статистических поправок, которые необходимо учитывать при расчете энтропии вещества методом Бенсона, является поправка к вращательной энтропии на симметрию молекул. При этом полное число симметрии молекулы![]() (total - общий) разбивают на два слагаемых:
(total - общий) разбивают на два слагаемых:
* на число симметрии наружного вращения молекулы в целом -![]() (наружное - external) и
(наружное - external) и
* число симметрии вращающейся части молекулы или число симметрии внутреннего вращения ![]() (внутреннее - internal). Полное число симметрии (
(внутреннее - internal). Полное число симметрии (![]() ) является произведением всех чисел симметрии молекулы:
) является произведением всех чисел симметрии молекулы:
![]() . (2.7)
. (2.7)
Число симметрии наружного вращения можно определить как число положений, которые может занимать жесткая многоатомная молекула (“жесткий ротатор”), совпадая при вращении со своей первоначальной конфигурацией.
Например, в двухатомных молекулах, состоящих из двух одинаковых атомов, последние могут поменяться местами при повороте молекулы на 180 градусов. Число симметрии наружного вращения таких молекул равно 2. Молекула CH4 представляет собой тетраэдр с атомами водорода в вершинах. Простым вращением молекулы вокруг каждой из связей “углерод-водород” можно получить 12 идентичных конфигураций, т.е. число симметрии наружного вращения молекулы метана равно 12.
Простой способ расчета числа симметрии для наружного вращения молекулы состоит в перемножении чисел, определяющих степень симметрии всех независимых осей, на количество этих осей. Так, для рассмотренной молекулы метана имеем четыре независимые оси третьего порядка, каждая из которых совпадает со связью С–Н. Вокруг этих осей происходит вращение молекулы. Таким образом, число симметрии наружного вращения молекулы метана равно 12 (![]() = 4·3 = 12). Молекула бензола имеет шесть осей второго порядка: три из них проходят через углеродные атомы, расположенные напротив друг друга
= 4·3 = 12). Молекула бензола имеет шесть осей второго порядка: три из них проходят через углеродные атомы, расположенные напротив друг друга
![]()
а три делят пополам углерод-углеродные связи. Все оси симметрии проходят через центр симметрии молекулы бензола. Таким образом, число симметрии наружного вращения молекулы бензола равно 12 (![]() = 6·2 = 12).
= 6·2 = 12).
Если часть молекулы способна вращаться относительно остальной ее части, то симметрия вращающейся части вносит дополнительные нефиксированные положения. Это приводит к необходимости введения второго числа симметрии - ![]() .
.
Так, полное число симметрии молекул нормальных алканов равно 18 (![]() = = 2·9 = 18), где 2 - число симметрии наружного вращения молекулы по оси второго порядка, перпендикулярной основной цепи углерод-углеродных связей, а 9 - произведение чисел симметрии двух концевых метильных групп, каждая из которых имеет ось вращения третьего порядка.
= = 2·9 = 18), где 2 - число симметрии наружного вращения молекулы по оси второго порядка, перпендикулярной основной цепи углерод-углеродных связей, а 9 - произведение чисел симметрии двух концевых метильных групп, каждая из которых имеет ось вращения третьего порядка.
Для молекул разветвленных углеводородов с количеством метильных групп, равным “n”, число симметрии внутреннего вращения составляет ![]() , а общее число симметрии будет равно
, а общее число симметрии будет равно ![]() и может принимать весьма большие значения. Например, для неопентана (2,2-диметилпропана)
и может принимать весьма большие значения. Например, для неопентана (2,2-диметилпропана) ![]() где 12 - число симметрии наружного вращения молекулы, 3 - ось симметрии третьего порядка в метильных группах, 4 - количество метильных групп в молекуле.
где 12 - число симметрии наружного вращения молекулы, 3 - ось симметрии третьего порядка в метильных группах, 4 - количество метильных групп в молекуле.
При расчете энтропии органических соединений других классов необходимо учитывать возможность заторможенного вращения прочих структурных фрагментов. Например, в молекулах ароматических углеводородов ось симметрии второго порядка имеют незамещенный фенил (C6H5 -) и пара-фенилен (-С6H4-).
Дать графическую зависимость изотерм и выполнить их анализ. Указать фазовые состояния окиси этилена при рассматриваемых параметрах. Критические температура, давление и ацентрический фактор окиси этилена соответственно равны 469 К, 71 атм и 0,200.
Решение
1. Рассчитываются ![]() при интересующих температурах. Поскольку последние попадают в интервал, рассмотренный в примере 2.4, и на каждом из участков возможна линейная интерполяция теплоемкостей окиси этилена, то корректной будет и линейная интерполяция вычисленных в примере 2.4 значений
при интересующих температурах. Поскольку последние попадают в интервал, рассмотренный в примере 2.4, и на каждом из участков возможна линейная интерполяция теплоемкостей окиси этилена, то корректной будет и линейная интерполяция вычисленных в примере 2.4 значений ![]() . Таким образом, имеем
. Таким образом, имеем
![]() = (288,86–274,12)/100×62,8+274,12 = 283,38 Дж/(моль×К).
= (288,86–274,12)/100×62,8+274,12 = 283,38 Дж/(моль×К).
Аналогично при температурах 304,85, 422,10 и 492,45 К имеем соответственно 243,52, 262,13 и 272,96 Дж/(моль×К).
2. Рассчитываются приведенные температуры:
![]() = 304,85/469 = 0,65;
= 304,85/469 = 0,65; ![]() = 422,10/469 =0,90;
= 422,10/469 =0,90; ![]() = 492,45/469 =1,05;
= 492,45/469 =1,05; ![]() = 562,80/469 = 1,20.
= 562,80/469 = 1,20.
3. При полученных приведенных температурах и значениях приведенных давлений вычисляются значения ![]() c помощью таблиц Ли-Кеслера и рассчитанных величин
c помощью таблиц Ли-Кеслера и рассчитанных величин ![]() .
.
Для ![]() и
и ![]() = 3,55 атм имеем
= 3,55 атм имеем
![]() = 243,52 – ( –ln(1/3,55)+(0,122+0,2×0,309))×8,31441 = 231,5 Дж/(моль×К).
= 243,52 – ( –ln(1/3,55)+(0,122+0,2×0,309))×8,31441 = 231,5 Дж/(моль×К).
Фрагмент результатов расчета приведен в табл. 2.9 и 2.10, где жирным шрифтом выделены сведения, относящиеся к жидкому состоянию окиси этилена.

Рис. 2.2. Зависимость энтропии окиси этилена от давления
4. Зависимость ![]() от давления при избранных температурах приведена на рис. 2.2. Характер полученных графических зависимостей различен для изотерм, принадлежащих жидкому и газообразному состояниям вещества. Энтропия жидкости в меньшей степени зависит от давления, чем энтропия газа, что очевидно. Для докритической изотермы резкое изменение энтропии сопряжено с изменением фазового состояния вещества.
от давления при избранных температурах приведена на рис. 2.2. Характер полученных графических зависимостей различен для изотерм, принадлежащих жидкому и газообразному состояниям вещества. Энтропия жидкости в меньшей степени зависит от давления, чем энтропия газа, что очевидно. Для докритической изотермы резкое изменение энтропии сопряжено с изменением фазового состояния вещества.
Таблица 2.9
|
|
при приведенном давлении, |
при приведенном давлении, | ||||||||
|
| 0,010 | 0,050 | 0,100 | 0,200 | 0,400 | 0,010 | 0,050 | 0,100 | 0,200 | 0,400 |
| 0,65 | 0,023 | 0,122 | 7,052 | 6,368 | 5,694 | 0,055 | 0,309 | 7,832 | 7,829 | 7,824 |
| 0,90 | 0,009 | 0,046 | 0,094 | 0,199 | 0,463 | 0,013 | 0,068 | 0,14 | 0,301 | 0,744 |
| 1,05 | 0,006 | 0,030 | 0,060 | 0,124 | 0,267 | 0,007 | 0,034 | 0,069 | 0,140 | 0,292 |
| 1,20 | 0,004 | 0,021 | 0,042 | 0,085 | 0,177 | 0,004 | 0,019 | 0,037 | 0,075 | 0,149 |
Таблица 2.10
|
|
| ||||||||||||
| T, K | 0,71 | 3,55 | 7,1 | 14,2 | 28,4 | 42,6 | 56,8 | 71 | 85,2 | 106,5 | ||
| 304,85 | 246,1 | 231,5 | 155,6 | 155,5 | 155,3 | 155,2 | 155,1 | 154,9 | 154,8 | 154,6 | ||
| 422,10 | 264,9 | 251,1 | 244,8 | 237,9 | 229,2 | 189,4 | 188,9 | 188,6 | 188,2 | 187,7 | ||
| 492,45 | 275,7 | 262,1 | 256,0 | 249,6 | 242,4 | 237,3 | 232,8 | 228,1 | 222,0 | 212,4 | ||
| 562,80 | 286,2 | 272,6 | 266,7 | 260,5 | 253,8 | 249,5 | 246,1 | 243,1 | 240,4 | 236,5 | ||
Таким образом, при увеличении давления энтропия веществ, находящихся в газообразном состоянии, уменьшается, поскольку возрастает упорядоченность системы.
Похожие работы
... - + 14H+ → 2MnO4- + 5Bi3+ + 7H2O №37: 3HNO2 = HNO3 + 2NO + H2O Восстановитель: HNO2 Окислитель: HNO2 Данная окислительно-восстановительная реакция относится к реакциям диспропорционирования, т.к. молекулы одного и того же вещества (HNO2) способны окислять и восстанавливать друг друга. Это происходит потому, что вещество HNO2 содержит в своем составе атомы азота в промежуточной ...
... о биологической причинности. Ряд феноменов, которые витализм считал специфическими для биологических объектов (способность к саморегуляции, усложнение строения, достижение одного результата разными способами) рассматриваются в современном естествознании как типичные проявления процессов самоорганизации любых достаточно сложных систем, а не только живых. Н.Бор: “ни один результат биологического ...
... или кислот; так получают, например, золь гидроксида железа(III), имеющий следующее строение: {[Fe(OH)3]m n FeO+ · (n–x)Cl–}x+ x Cl– 4.2.2 Агрегативная устойчивость лиофобных коллоидов. Строение коллоидной мицеллы Лиофобные коллоиды обладают очень высокой поверхностной энергией и являются поэтому термодинамически неустойчивыми; это делает возможным самопроизвольный процесс уменьшения ...
... , г/см3, то переход от одной концентрации к другой можно представить следующими формулами (раствор, естественно, бинарный): 7.2. Характеристические функции многокомпонентных систем. Первый и второй законы термодинамики, из которых следуют фундаментальные уравнения, были получены для закрытых систем, т.е. систем, процессы в которых не приводят к изменению количества компонентов. Реально же ...


0 комментариев