Навигация
Химические соединения на основе кремния и углерода
Содержание
Введение
Глава 1. Кремний и углерод - химические элементы
1.1 Общие сведения об углероде и кремнии
1.2 Получение, химические свойства и применение простых веществ
Глава 2. Химические соединения углерода
2.1 Кислородные производные углерода
2.1.1 Степень окисления +2
2.1.2 Степень окисления +4
2.2 Азотсодержащие производные углерода
2.3 Карбиды металлов
2.3.1 Карбиды, растворимые в воде и разбавленных кислотах
2.3.2 Карбиды, нерастворимые в воде и в разбавленных кислотах
Глава 3. Соединения кремния
3.1 Кислородные соединения кремния
Выводы
Список литературы
Введение
Химия - одна из отраслей естествознания, предметом изучения которой являются химические элементы (атомы), образуемые ими простые и сложные вещества (молекулы), их превращения и законы, которым подчиняются эти превращения.
По определению Д.И. Менделеева (1871), "химию в современном ее состоянии можно... назвать учением об элементах".
Происхождение слова "химия" выяснено не окончательно. Многие исследователи полагают, что оно происходит от старинного наименования Египта - Хемиа (греческое Chemia, встречается у Плутарха), которое производится от "хем" или "хаmе" - черный и означает "наука черной земли" (Египта), "египетская наука" [1, 279-280].
Современная химия тесно связана, как с другими естественными науками, так и со всеми отраслями народного хозяйства.
Качественная особенность химической формы движения материи, и ее переходов в другие формы движения обуславливает разносторонность химической науки и ее связи с областями знания, изучающими и более низшие, и более высшие формы движения. Познание химической формы движения материи обогащает общее учение о развитии природы, эволюции вещества во Вселенной, содействует становлению целостной материалистической картины мира. Соприкосновение химии с другими науками порождает специфические области взаимного их проникновения. Так, области перехода между химией и физикой представлены физической химией и химической физикой. Между химией и биологией, химией и геологией возникли особые пограничные области - геохимия, биохимия, биогеохимия, молекулярная биология. Важнейшие законы химии формулируются на математическом языке, и теоретическая химия не может развиваться без математики. Химия оказывала и оказывает влияние на развитие философии, и сама испытывала и испытывает её влияние.
Исторически сложились два основных раздела химии: неорганическая химия, изучающая в первую очередь химические элементы и образуемые ими простые и сложные вещества (кроме соединений углерода), и органическая химия, предметом изучения которой являются соединения углерода с др. элементами (органические вещества).
До конца 18 века термины "неорганическая химия" и "органическая химия" указывали лишь на то, из какого "царства" природы (минерального, растительного или животного) получались те или иные соединения. Начиная с 19 в. эти термины стали указывать на присутствие или отсутствие углерода в данном веществе. Затем они приобрели новое, более широкое значение. Неорганическая химия соприкасается прежде всего с геохимией и далее с минералогией и геологией, т.е. с науками о неорганической природе. Органическая химия представляет отрасль химии, которая изучает разнообразные соединения углерода вплоть до сложнейших биополимерных веществ. Через органическую и биоорганическую химию химия граничит с биохимией и далее с биологией, т.е. с совокупностью наук о живой природе. На стыке между неорганической и органической химией находится область элементоорганических соединений.
В химии постепенно сформировались представления о структурных уровнях организации вещества. Усложнение вещества, начиная от низшего, атомарного, проходит ступени молекулярных, макромолекулярных, или высокомолекулярных, соединений (полимер), затем межмолекулярных (комплекс, клатрат, катенан), наконец, многообразных макроструктур (кристалл, мицелла) вплоть до неопределённых нестехиометрических образований. Постепенно сложились и обособились соответствующие дисциплины: химия комплексных соединений, полимеров, кристаллохимия, учения о дисперсных системах и поверхностных явлениях, сплавах и др.
Изучение химических объектов и явлений физическими методами, установление закономерностей химических превращений, исходя из общих принципов физики, лежит в основе физической химии. К этой области химии относится ряд в значительной мере самостоятельных дисциплин: термодинамика химическая, кинетика химическая, электрохимия, коллоидная химия, квантовая химия и учение о строении и свойствах молекул, ионов, радикалов, радиационная химия, фотохимия, учения о катализе, химических равновесиях, растворах и др. Самостоятельный характер приобрела аналитическая химия, методы которой широко применяются во всех областях химии и химической промышленности. В областях практического приложения химии возникли такие науки и научные дисциплины, как химическая технология с множеством её отраслей, металлургия, агрохимия, медицинская химия, судебная химия и др.
Как уже было сказано выше, химия рассматривает химические элементы и образуемые ими вещества, а также законы, которым подчиняются эти превращения. Один из этих аспектов (а именно, химические соединения на основе кремния и углерода) и будет рассмотрен мной в данной работе.
Глава 1. Кремний и углерод - химические элементы
1.1 Общие сведения об углероде и кремнии
Углерод (С) и кремний (Si) входят в группу IVA.
Углерод не принадлежит к числу очень распространенных элементов. Несмотря на это, значение его огромно. Углерод-основа жизни на земле. Он входит в состав весьма распространенных в природе карбонатов (Са, Zn, Mg, Fe и др.), в атмосфере существует в виде СО2, встречается в виде природных углей (аморфного графита), нефти и природного газа, а также простых веществ (алмаза, графита).
Кремний по распространенности в земной коре занимает второе место (после кислорода). Если углерод - основа жизни, то кремний-основа земной коры. Он встречается в громадном многообразии силикатов (рис 4) и алюмосиликатов, песка.
Аморфный кремний - порошок бурого цвета. Последний легко получить в кристаллическом состоянии в виде серых твердых, но довольно хрупких крис таллов. Кристаллический кремний - полупроводник. [4,453-454]
Таблица 1. Общие химические данные об углероде и кремнии.
| С | Sі | |
| Электронная конфигурация | 2s22p2 | 3s23р2 |
| Ковалентный радиус, нм | 0,077 | 0,118 |
| Ионный радиус, нм | 0,016 | 0,040 |
|
| (+4) | (+4) |
| Энергия ионизации, эВ | 11,26 | 8,15 |
| Сродство к электрону, эВ | 1,27 | 1,36 |
| Тпл, К | 4023 | 1693 |
| Ткип, К | 4473 | 3573 |
| Плотность, г/см3 | 2,26 | 2,33 |
| Твердость по шкале Мооса | 10 | 7 |
| Электроотрицательность | 2,50 | 1,74 |
| Степень окисления | - 2, 2, 4 | - 4, 2, 4 |
| Содержание в земной коре, масс % | 9.10-2 | 16,7 |
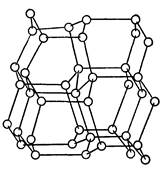
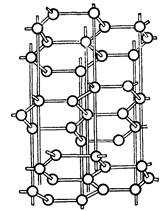
Устойчивая при обычной температуре модификация углерода - графит - представляет собой непрозрачную, серую жирную массу. Алмаз - самое твердое вещество на земле - бесцветен и прозрачен. Кристаллические структуры графита и алмаза приведены на рис.1.
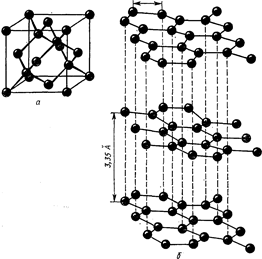
Рисунок 1. Структура алмаза (а); структура графита (б)
Углерод и кремний имеют свои определенные производные.
Таблица 2. Наиболее характерные производные углерода и кремния
| Гидриды | Оксиды | Сульфиды | Хлориды | Комплексные соединения |
| СН4 | СО, СО2 | cs, cs., | CCl4 | |
| SiH, | SiOa, (SiО | SiS, SiS2 | SiCl4 | H2 [SiF6], K2 [SiF6], |
| в парах) | MІ4Si (Мо3О10),] |
1.2 Получение, химические свойства и применение простых веществ
Кремний получают восстановлением оксидов углеродом; для получения в особо чистом состояний после восстановления вещество переводят в тетрахлорид и снова восстанавливают (водородом). Затем сплавляют в слитки и подвергают очистке методом зонной плавки. Слиток металла нагревают с одного конца так, чтобы в нем образовалась зона расплавленного металла. При перемещении зоны к другому концу слитка примесь, растворяясь в расплавленном металле лучше, чем в твердом, выводится, и тем самым металл очищается.
Углерод инертен, но при очень высокой, температуре (в аморфном состоянии) взаимодействует с большинством металлов с образованием твердых растворов или карбидов (СаС2, Fе3С и т.д.), а также со многими металлоидами, например:
2С+ Са = СaC2,С + 3Fe = Fe3C,
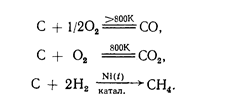
Кремний более реакционно способен. С фтором он реагирует уже при обычной температуре: Si+2F2=SiF4
У кремния очень большое сродство также и к кислороду:
![]()
Реакция с хлором и серой протекает около 500 К. При очень высокой температуре кремний взаимодействует с азотом и углеродом:
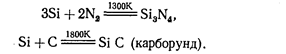
С водородом кремний непосредственно не взаимодействует. Кремний растворяется в щелочах:
Si+2NaOH+H20=Na2Si03+2H2.
Кислоты, кроме плавиковой, на него не действуют. С HF идет реакция
Si+6HF=H2 [SiF6] +2H2.
Углерод в составе различных углей, нефти, природных (в основном СН4), а также искусственно полученных газов - важнейшая топливная база нашей планеты [4,17]
Графит широко используется для изготовления тиглей. Стержни из графита применяются как электроды. Много графита идет на производство карандашей. Углерод и кремний применяются для производства различных сортов чугуна. В металлургии углерод используется как восстановитель, а кремний из-за большого сродства к кислороду-как раскислитель. Кристаллический кремний в особо чистом состоянии (не более 10-9 ат.% примеси) используется как полупроводник в различных устройствах и приборах, в том числе в качестве транзисторов и термисторов (приборов для очень тонких измерений температур), а также в фотоэлементах, работа которых основана на способности полупроводника при освещении проводить ток.
Глава 2. Химические соединения углерода
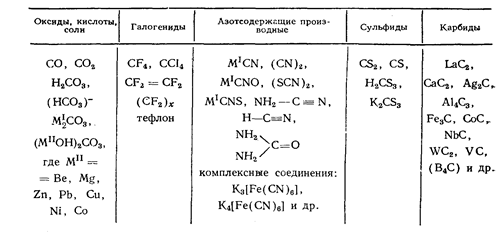
Для углерода характерны прочные ковалентные связи между собственными атомами (С-С) и с атомом водорода (С-Н), что нашло отражение в обилии органических соединений (несколько сот миллионов). Кроме прочных связей С-Н, С-С в различных классах органических и неорганических соединений, широко представлены связи углерода с азотом, серой, кислородом, галогенами, металлами (см. табл.5). Столь высокие возможности образования связей обусловлены малыми размерами атома углерода, позволяющими его валентным орбиталям 2s2, 2p2 максимально перекрываться. Важнейшие неорганические соединения описаны в таблице 3.
Среди неорганических соединений углерода уникальными по составу и строению являются азотсодержащие производные.
В неорганической химии широко представлены производные уксусной СНзСООН и щавелевой H2C2О4 кислот - ацетаты (типа М'СНзСОО) и оксалаты (типа MI2C2О4).
Таблица 3. Важнейшие неорганические соединения углерода.
2.1 Кислородные производные углерода
2.1.1 Степень окисления +2
Оксид углерода СО (угарный газ): по строению молекулярных орбиталей (табл.4).
СО аналогичен молекуле N2. Подобно азоту СО обладает высокой энергией диссоциации (1069 кДж/ моль), имеет низкую Тпл (69 К) и Ткип (81,5 К), плохо растворим в воде, инертен в химическом отношении. В реакции СО вступает лишь при высоких температурах, в том числе:
СО+Сl2=СОСl2 (фосген),
СО+Вг2=СОВг2,Сг+6СО=Сг (СО) 6-карбонил хрома,
Ni+4CO=Ni (CO) 4 - карбонил никеля
СО+Н20пар=НСООН (муравьиная кислота).
Вместе с тем молекула СО имеет большое сродство к кислороду:
СО +1/202 =С02+282 кДж/моль.
Из-за большого сродства к кислороду оксид углерода (II) используется как восстановитель оксидов многих тяжелых металлов (Fe, Co, Pb и др.). В лаборатории оксид СО получают обезвоживанием муравьиной кислоты
![]()
В технике оксид углерода (II) получают восстановлением С02 углем (С+С02=2СО) или окислением метана (2СН4+ЗО2= =4Н20+2СО).
Среди производных СО представляют большой теоретический и определенный практический интерес карбонилы металлов (для получения чистых металлов). [3,289]
![]() Химические связи в карбонилах образуются в основном по донорно-акцепторному механизму за счет свободных орбиталей d-элемента и электронной пары молекулы СО, имеет место также л-перекрывание по дативному механизму (металл СО). Все карбонилы металлов - диамагнитные вещества, характеризующиеся невысокой прочностью. Как и оксид углерода (II), карбонилы металлов токсичны.
Химические связи в карбонилах образуются в основном по донорно-акцепторному механизму за счет свободных орбиталей d-элемента и электронной пары молекулы СО, имеет место также л-перекрывание по дативному механизму (металл СО). Все карбонилы металлов - диамагнитные вещества, характеризующиеся невысокой прочностью. Как и оксид углерода (II), карбонилы металлов токсичны.
Таблица 4. Распределение электронов по орбиталям молекулы СО
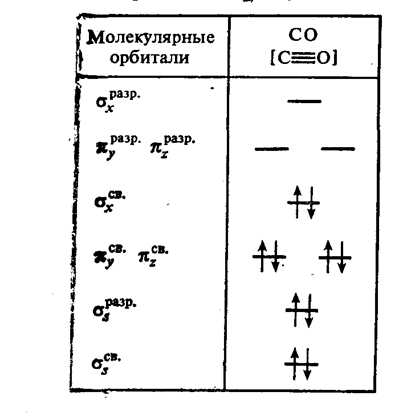
2.1.2 Степень окисления +4
Диоксид углерода С02 (углекислый газ). Молекула С02 линейна. Энергетическая схема образования орбиталей молекулы С02 приведена на рис.2. Оксид углерода (IV) может взаимодействовать с аммиаком по реакции.
![]()
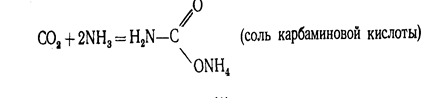
При нагревании этой соли получают ценное удобрение - карбамид СО (МН2) 2:
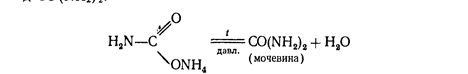
Мочевина разлагается водой
CO (NH2) 2+2HaO= (МН4) 2СОз.
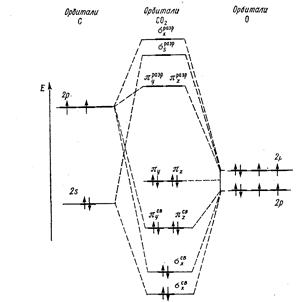
Рисунок 2. Энфгетическая диаграмма образования молекулярных орбиталей С02.
В технике оксид СО2 получают разложением карбоната кальция или гидрокарбоната натрия:
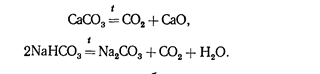
В лабораторных условиях его обычно получают по реакции (в аппарате Киппа)
СаСОз+2НС1=СаС12+С02+Н20.
Важнейшими производными С02 являются слабая угольная кислота Н2СОз и ее соли: MI2СОз и MIНСОз (карбонаты и гидрокарбонаты соответственно).
Большинство карбонатов нерастворимо в воде. Растворимые в воде карбонаты подвергаются значительному гидролизу:
![]()
![]() COз2-+H2
COз2-+H2
Похожие работы
... биохимических процессов на планетах, подобных нашей. Остается возможность того, что при других условиях температуры и давления, кремний может участвовать в формировании биологических молекул в качестве замены углероду. Следует отметить, что соединения кремния (в частности, диоксид кремния) используются некоторыми организмами на земле. Из них свой панцирь формируют диатомовые водоросли, получая ...
... разовая) – 0,01%. 4 Содержание Введение......................................................................................................................4 Глава 1. Межпредметные связи в курсе школьного предмета химии на примере углерода и его соединений.......................................................................5 1.1 Использование межпредметных связей для формирования у учащихся ...
... для которого служит специально получаемый высокомарганцевый низкофосфористый шлак) применяется в производстве металлического марганца. Силикохром Силикохром, ферросиликохром, ферросплав, основные компоненты которого — кремний и хром; выплавляется в рудно-термической печи углевосстановительным процессом из кварцита и гранулированного передельного феррохрома или хромовой руды. С. с 10—46% Si ( ...
... инертны и практически не взаимодействуют ни с какими простыми и сложными веществами. Исключение составляет аморфный кремний, реагирующий с фтором. При нагревании углерод и кремний взаимодействуют с галогенами, с элементами подгруппы серы, азотом, водородом и многими металлами. В последнем случае образуются соединения, называемые карбидами и силицидами. С углеродом и кремнием взаимодействуют ...
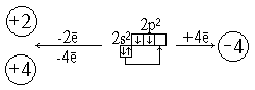

0 комментариев