Навигация
Гази у зовнішньому силовому полі та основи термодинаміки
лекції з навчальної дисципліни
Ф І З И К А
Тема: "ГАЗИ У ЗОВНІШНЬОМУ СИЛОВОМУ ПОЛІ"
Вступ
Основні закони ідеального газу, одержані експериментально, успішно пояснюються, при певних умовах, молекулярно-кінетичною теорією газів. Причому розподіл молекул по швидкостям характеризуються функцією Максвелла.
Атмосфера Землі, при певних умовах, може розглядатись як ідеальний газ, який знаходиться в полі тяжіння Землі і це, безперервно, впливає на поводження атомів і молекул газової оболонки Землі. Важливо знати цей вплив і будову атмосфери, оскільки в верхніх шарах існують шари з великою концентрацією зарядів, які впливають на розповсюдження радіохвиль навколо Землі. Отже ці питання мають велике практичне значення для радіозв’язку. Рух молекул в газі залежить також і від тиску. При певних умовах виникає вакуум, з певними особливостями, які використовуються на практиці. Ці, та питання термодинаміки важливо вияснити на занятті для загального розвитку слухачів.
Ідеальний газ в зовнішньому силовому полі. Розподіл Больцмана. Барометрична формула
Функція розподілу молекул під дією поля зовнішніх сил (в залежності від їх потенціальної енергії) знайшов Больцман. Різниця тисків на рівнях, які відрізняються на високу Dh, дорівнює:
![]() .
.
Перейшовши до нескінченно малих, маємо:
![]() .
.
З другого боку, згідно основного рівняння молекулярно-кінетичної теорії газу, p =nkT, звідки знаходимо:
![]() .
.
Отже,
![]()
або
![]() .
.
Потенціюємо і одержуємо:
![]() .
.
В загальному випадку розподіл молекул по енергіям в потенціальному полі буде таким:
![]()
Це і є закон Больцмана, який показує, що при даній температурі Т концентрація частинок n зростає їх зменшенням енергії W, тобто що частинки концентруються в місцях з меншою потенціальною енергією – тобто в місцях стійкої рівноваги. Але із збільшенням Т при сталій енергії W різниця концентрації п і по згладжується. Таким чином сили поля «намагаються вдержати» частинки по всьому об’єму. При T® 0 молекули атмосфери упали б на Землю. Існування атмосфери можливе завдяки тепловому рухові молекул. Так як p =nkT, а ![]() і вважаючи T = const із закону Больцмана маємо:
і вважаючи T = const із закону Больцмана маємо:
![]() або
або ![]()
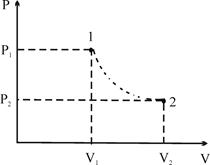
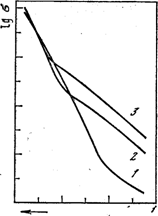
це барометрична формула, з якої витікає, що тиск атмосфери із збільшенням висоти зменшується по експоненціальному закону (рис. 1).
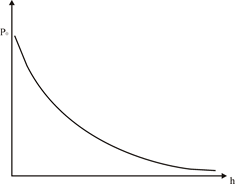
Рис. 1
Закон Больцмана характеризує розподіл частинок в будь-якому силовому полі і використовується для електронів в електричному полі в металах, напівпровідниках і т.д.
Будова атмосфери, іоносфери та навколоземного космічного простору
Атмосфера Землі – газове, повітряне середовище навколо Землі, яке обертається разом з Землею як єдине ціле; її маса ![]() . Склад атмосфери біля поверхні Землі 78,1% азоту, 21% кисню, 0,9% аргону, в незначних долях процента присутні вуглекислий газ, водень, гелій, неон і інші гази. Процентне співвідношення основних газів атмосфери мало змінюється до висоти біля 100 км (в гомосфері). На висоті 20–25 км розміщений шар озона, який захищає живі організми на Землі від шкідливого короткохвильового випромінювання.
. Склад атмосфери біля поверхні Землі 78,1% азоту, 21% кисню, 0,9% аргону, в незначних долях процента присутні вуглекислий газ, водень, гелій, неон і інші гази. Процентне співвідношення основних газів атмосфери мало змінюється до висоти біля 100 км (в гомосфері). На висоті 20–25 км розміщений шар озона, який захищає живі організми на Землі від шкідливого короткохвильового випромінювання.
В нижчих 20 км шарах в атмосфері знаходиться ще водяна пара, кількість якої з висотою швидко зменшується; а також тверді та рідкі аерозольні частинки (пил, дим, продукти конденсації водяної пари). Вище 100 км (гетеросфері) склад повітря починає змінюватися з висотою: зростає доля легких газів і на дуже великих висотах переважаючим стають гелій та водень; частина молекул розпадається на атоми та іони утворюючи іоносферу.
Тиск та густина повітря в атмосфері з висотою зменшується. Температура змінюється з висотою більш складніше, і в залежності від її розподілення атмосфери підрозділяють на тропосферу, стратосферу, мезосферу, екзосферу. В атмосфері розсіюється і поглинається сонячна та земна радіація; в свою чергу атмосфера сама є джерелом інфрачервоного випромінювання. Між поверхнею Землі та атмосферою відбувається обмін теплом і вологістю, відтворюючи постійний кругообіг води з утворенням хмар і випаданням опадів.
Атмосфера має електричне поле, в ній виникає різна електрика оптичні та акустичні явища. Повітря атмосфери знаходиться в безперервному русі. Нерівномірне нагрівання атмосфери визиває її загальну циркуляцію, яка впливає на погоду та клімат Землі.
Верхня атмосфера від 60 км і вище до 2000 км, характеризується наявністю рядом з нейтральними частинками (молекули та атоми) газу також вільних електронів, позитивних і негативних іонів, які утворюються при іонізації газів. Іонізація відбувається під дією електромагнітного випромінювання Сонця і потоку заряджених частинок (сонячного вітру), які визивають фото -, та ударну іонізацію космічних променів, випромінювання зірок та метеорів.
В цілому іоносфера являється квазінтральною, знаходиться в плазмовому стані.
Стан і будова іоносфери характеризується концентрацією або густиною вільних електронів. Величина електронної концентрації залежить від інтенсивності іонізації, яка змінюється з висотою, маючи деякий максимум, а іноді і декілька максимумів. Максимуми електронної концентрації інколи ототожнюють з положенням окремих областей або «шарів» іоносфери, які позначаються в порядку зростання висоти Д, Е, F1, F2.
Шар Д існує лише в денні і переважно влітку. Шар Е відзначається найбільшою стабільністю, а F2 – найбільшою змінною своїх параметрів. Параметри, в першу чергу електронна концентрація всіх шарів, залежить від географічних координат. Крім згаданих шарів, в верхній іоносфері існують радіаційні пояси, які розміщені навколо Землі і створені зарядженими частинками (в першу чергу протонами та електронами), захопленими магнітним полем Землі.
Шари іоносфери
| Параметри шарів | Іоносферні шари | |||
| Д | Е | F1 | F2 | |
| Висота шару | 60 – 90 | 100 – 140 | 170 – 240 | 230 – 400 |
| Напівтовщина | - | 15 – 20 | 20 – 100 | 50 – 200 |
| Електронна концентрація N ел/м3 | 108 – 109 | 109-2.1010 | 2.1010 –1,5.1011 | 2.1011-2.1012 |
| Число зіткнень електронів з нейтральними молекулами | 107 | 105 | 104 | 103 |
Середня довжина вільного пробігу молекул газу. Поняття про технічний вакуум
В ідеальному газі зіткнення молекул, кажучи взагалі, виключені, поскільки молекули такого газу являють собою (згідно визначення) матеріальні точки, тобто, не мають розмірів.
Між двома послідовними співударами молекула газу проходить деякий шлях, який називається довжиною вільного пробігу.
Довжина цього шляху для різних молекул різна, але дякуючи великій кількості молекул та хаотичному їх руху можна говорити про середню довжину вільного пробігу.
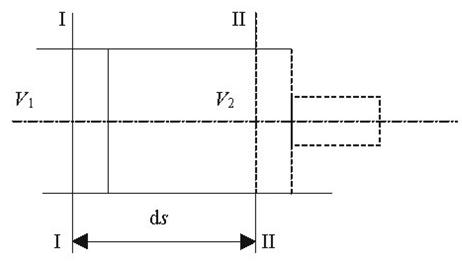
Обчислимо середню довжину вільного пробігу молекул. Розглянемо молекулу, яка рухається з середньою арифметичною швидкістю n. Після кожного співудару молекула змінює напрямок швидкості (рис. 2).
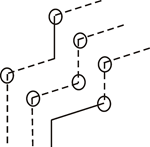
Рис. 2
Для простоти допустимо, що молекула після зіткнення продовжує рухатись в тому ж напрямку. Будемо також вважати, що всі інші молекули, крім розглядуваної нерухомі. Тоді рухома молекула зіткнеться на своєму шляху з молекулами, центри яких лежать на віддалі не більше 2r від прямої, вздовж якої вона рухається. Значить за одиницю часу молекула зіткнеться з всіма молекулами, центри яких лежать всередині циліндра, радіусом R=2r і довжиною n. Число цих молекул буде дорівнювати добутку об’єму циліндра на число молекул в одиниці об’єму.
![]() (1)
(1)
Враховуючи, що R=2r, знайдемо, що середнє число зіткнень молекул за одиницю часу, дорівнює:
![]() (2)
(2)
Проте, в дійсності рухаються всі молекули. Тому ефективна довжина циліндра буде дорівнювати ![]() . Значить, виправлене значення середнього числа щосекундних зіткнень буде таким:
. Значить, виправлене значення середнього числа щосекундних зіткнень буде таким:
![]() (3)
(3)
Радіус молекули складає величину порядку 10-10 м. При нормальних умовах в 1 м3 газу знаходиться 3.1026 молекул, а середня арифметична швидкість ![]() . Підставляючи ці значення в (3), одержимо:
. Підставляючи ці значення в (3), одержимо:
![]()
Таким чином, при нормальних умовах молекули стикаються міліарди раз в секунду.
Середню довжину вільного шляху молекули одержали, розділивши середній шлях, пройдений нею за одиницю часу ![]() , на число зіткнень за одиницю часу n.
, на число зіткнень за одиницю часу n.
![]() (4)
(4)
Підставляючи сюди по (3), одержимо:
![]() (5)
(5)
З формули (5) виходить, що середня довжина вільного пробігу молекул залежить від діаметра молекул і числа їх в одиниці об’єму. Підставивши в формулу (5) замість по його значення з основного рівняння кінетичної теорії (р=поТ) одержимо:
![]() (6)
(6)
З формули (6) виходить, що середня довжина вільного пробігу молекул обернено пропорційна тиску газу.
Стан розрідження газу, при якому молекулярні співудари або зовсім відсутні, або ж являються мало чисельними в порівнянні з числом ударів молекул об стінки посудини, називають вакуумом.
Отже, поняття «вакуум» відносне. Воно взагалі застосовується лише для газу, що знаходиться в об’ємі, обмеженому стінками.
Теорія і дослід показує, що фізичні процеси в газах, в яких зіткнення молекул між собою відбувається дуже рідко в порівнянні із зіткненнями молекул зі стінками, протікає інакше, ніж тоді, число взаємних зіткнень молекул велике. Отже при переході до вакууму змінюється характер протікання фізичних процесів (дифузія, теплопровідність, внутрішнє тертя). Число взаємних зіткнень молекул буде незначним, як що довжина їх вільного пробігу більша чи рівна розміром посудини.
Тому в фізиці вакуумом називають таке розрідження, при якому середня довжина вільного пробігу молекул газу має величину порядку розмірів посудини або перевищує його. Газ в стані високого вакууму називають ще ультрарозрідженим газом.
Високий вакуум в даний час грає велику роль як в лабораторних дослідженнях, так і в техніці. Він широко застосовується для різних електротехнічних і радіотехнічних цілей (електроламп, радіоламп, рентгенівських трубок, електронно-променевих трубок і ін.), в прискорювачах заряджених частинок і т.д. Це дало потужний поштовх для розвитку вакуумної техніки.
Перший і другий закони термодинаміки. Максимальний КПД теплової машини. Поняття про ентропію
Із механіки відомо, що будь-яке тіло, або система тіл можуть мати кінетичну і потенціальну енергію і являє собою матеріальну точку. Але кожне тіло складається з дуже великого числа частинок (атомів, іонів, молекул), які безперервно рухаються і взаємодіють між собою. Отже всі частинки тіла називаються внутрішньою енергією – U. Отже повна енергія тіла буде
![]() .
.
Внутрішня енергія U є однозначною функцією стану тіла, або системи і визначається його параметрами.
Обрахувати внутрішню енергію дуже складно, а на практиці, здебільшого обраховують зміну внутрішньої енергії DU. Якщо наприклад, взяти ідеальний газ, молекули якого – матеріальні точки, що не взаємодіють між собою, то враховуючи що середня кінетична енергія молекули ![]() , для моля
, для моля ![]() або
або ![]() , а для будь-якої маси газу
, а для будь-якої маси газу ![]() , а зміна внутрішньої енергії
, а зміна внутрішньої енергії ![]() .
.
В загальному ж випадку внутрішня енергія складається із
А) кінетичної енергії поступального руху частинок,
Б) потенціальної енергії взаємодії частинок,
В) енергії коливального руху частинок біля положення рівноваги,
Г) енергії електронних оболонок атомів та молекул,
Д) енергій взаємодії нуклонів в ядрі.
Внутрішня енергія тіла або системи буде змінюватись при взаємодії з зовнішніми тілами, причому в випадках: або при здійсненні роботи, або при теплообміні.
Якщо система нерухома, то робота виконується при зміні об’єму тіла ![]() – це робота яку здійснюють зовнішні сили. По закону збереження енергії
– це робота яку здійснюють зовнішні сили. По закону збереження енергії ![]() , де DA – робота яку здійснює система проти зовнішніх сил. Якщо ж система одержує також енергію у вигляді тепла DQ, то на основі закону збереження енергії
, де DA – робота яку здійснює система проти зовнішніх сил. Якщо ж система одержує також енергію у вигляді тепла DQ, то на основі закону збереження енергії ![]() , або
, або ![]() , отже
, отже
![]() (7)
(7)
це і є перший закон термодинаміки: теплота, одержана системою витрачається на зміну внутрішньої енергії системи і на виконання роботи системою проти зовнішніх сил.
Перший закон термодинаміки являє собою закон збереження і перетворення енергії.
Із першого закону (7) випливає, що якщо DQ = 0, то DA = – DU, отже робота системою може виконуватись, без споживання зовнішньої енергії, але за рахунок зменшення внутрішньої енергії. Але внутрішня енергія – величина кінетична, отже кінетичною буде і робота. Таким чином: вічний двигун першого роду неможливий, це також формулювання першого закону термодинаміки.
Перший закон термодинаміки – це загальний закон збереження енергії, але він нічого не говорить про напрямок передачі теплоти. На основі численних дослідів було встановлено:
теплота ніколи не може переходити сама собою від тіл з більш низькою температурою до тіл з більш високою температурою – це другий закон термодинаміки, який можна формулювати і так: неможливий процес, єдиним результатом якого було б перетворення всієї теплоти, одержаної від деякого тіла, в еквівалентну їй роботу.
Якщо, наприклад, від нагрівника з температурою Т, одержується певна кількість теплоти, то щоб теплова машина працювала, необхідно щоб був і холодильник з температурою Т2 Т1, якому передається частина теплоти. Отже, не вся одержана теплота перетворюється в роботу. Частина її втрачається – віддається холодильнику, або розсіюється в просторі.
Розрахунки показують, що максимальний КПД теплової машини рівний:
![]() (8)
(8)
Із другого закону термодинаміки витікає, що величина
![]() (9)
(9)
є повним диференціалом функції S яку назвали ентропією.
Ентропія S це величина, яка однозначно (як і внутрішня енергія) характеризує стан системи. Відношення ![]() називають зведеною кількістю теплоти.
називають зведеною кількістю теплоти.
Із другого закону термодинаміки слідує, що ентропія замкненої системи може тільки збільшитись і всі процеси протікають так, що ймовірність стану системи може тільки збільшитись. Отже при будь-якому процесі система переходить із менш ймовірного стану в більш ймовірний стан.
Висновки
1. Якщо газ знаходиться в силовому полі, то розподіл молекул описується формулою Больцмана – чим більшу потенціальну енергію мають молекули, тим таких молекул менше. Тиск атмосфери із збільшенням висоти експоненціально зменшується.
2. Атмосфера Землі має складну будову і на розповсюдження радіохвиль великий вплив мають іонізаційні шари.
3. Середня довжина вільного пробігу молекул l обернено пропорційна тиску газу. Якщо l більше розмірів посудини то такий стан називають вакуумом.
4. Перший закон термодинаміки – це один із загальних законів природи – закон збереження енергії. Другий закон термодинаміки характеризує напрям протікання теплових процесів. Самовільно теплота передається тільки від нагрітих тіл до холодних.
План
лекції з навчальної дисципліни
Ф І З И К А
Тема: "ОСНОВИ ТЕРМОДИНАМІКИ"
Вступ
Частина фізики, що вивчає загальні властивості речовин, пов’язаних з тепловим рухом в умовах рівноваги, називається т.е. р м о д и н а м і к о ю.
Особливе положення термодинаміки пов’язане з тим, що будь-яка форма енергії при її перетворенні на кінець переходить в енергію теплового руху. В тепло переходить механічна енергія / тіла, що труться, нагріваються /, енергія електричного струму, світла, хімічних реакцій, тощо.
Найбільш практичний інтерес має перетворення механічної енергії в теплову і зворотній процес одержання механічної роботи за рахунок теплової енергії.
В основі термодинаміки лежать два закони /начала/ термодинаміки, які відносяться тільки до систем з великою кількістю частинок.
Перший закон термодинаміки
Будь-яке тіло або система тіл має механічну енергію / кінетичну та потенціальну/, так і внутрішню, яка складається з кінетичної енергії теплового поступального та обертального руху молекул, коливань атомів в молекулах, потенціальної енергії міжмолекулярної взаємодії, енергії електронів в атомі та енергії нуклонів в ядрі. Внутрішня енергія одноатомного ідеального газу повністю визначається його абсолютною температурою і дорівнює
![]() .
.
У відсутності взаємодії між системою і зовнішнім середовищем внутрішня енергія системи не змінюється.
Внутрішня енергія системи змінюється при взаємодії системи з зовнішніми тілами. При цьому обмін енергіями відбувається або при виконанні роботи, або шляхом теплообміну.
Кількість енергії, що передають системі зовнішні тіла при взаємодії, називається роботою. Якщо система нерухома, то виконання роботи відбувається при зміні об’єму системи зовнішніми силами:
![]()
По закону збереження енергії робота ![]() , що виконують зовнішні сили над системою, чисельно дорівнює роботі DA, що виконує система проти зовнішніх сил:
, що виконують зовнішні сили над системою, чисельно дорівнює роботі DA, що виконує система проти зовнішніх сил:
![]()
Кількість енергії, що передають системі зовнішні тіла шляхом теплообміну, називають кількістю теплоти, наданої системі
![]()
![]()
де с – питома теплоємність, це – фізична величина, яка дорівнює кількості теплоти, що необхідно надати одиниці маси речовини, щоб змінити її температуру на I K.
Крім цього, використовують молярну теплоємність ![]() , яка зв’язана з питомою співвідношенням:
, яка зв’язана з питомою співвідношенням:
![]() ,
,
де m – молярна маса речовини.
Тоді:
![]()
В механіці виконується закон збереження механічної енергії. А оскільки тепловий рух – це також механічний рух окремих молекул, то при всіх змінах енергії повинен виконуватись закон збереження енергії з урахуванням не тільки зовнішнього, а й внутрішнього рухів. Тому. Зміна внутрішньої енергії повинна дорівнювати сумі роботи ![]() , що виконують зовнішні сили над системою та кількості теплоти, що надасться системі.
, що виконують зовнішні сили над системою та кількості теплоти, що надасться системі.
![]() .
.
Частіше розглядають не роботу зовнішніх сил над системою, а роботу системи проти зовнішніх сил /![]() /, а оскільки
/, а оскільки
![]()
![]() , то
, то ![]() , або
, або ![]() /1/ _
/1/ _
це – математичний запис закону збереження енергії в теплових процесах, або перший закон термодинаміки: теплота, що надасться системі, витрачається на зміну внутрішньої енергії системи та на виконання системою роботи проти зовнішніх сил.
З першого закону термодинаміки виходить, що якщо DQ = 0, то DA = -DU. Таким чином, якщо система не одержує енергії, то вона виконує роботу тільки за рахунок зменшення внутрішньої енергії, яка кінцева. Кінцевою буде і робота. Отже: вічний двигун першого роду неможливий – це також формуліровка першого закону термодинаміки.
Розглянемо використання 1-го закону термодинаміки до ізопроцесів в ідеальному газі. Оскільки
![]() , а
, а ![]() V,
V,
то ![]() .
.
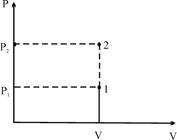
1. Ізохоричний процес /V=const/ здійснюється при нагріванні газу в замкненому об’ємі. Оскільки DV = 0, то А=0, і тоді I закон термодинаміки запишеться так:
DQ =DU – вся теплота, що надасться системі, використовується на зміну внутрішньої енергії:
![]() , /2/
, /2/
де ![]() – молярна теплоємність при сталому об’ємі /V=const/.
– молярна теплоємність при сталому об’ємі /V=const/.
![]() .
.
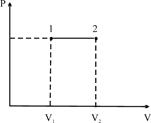
2. Ізобаричний процес /р =const/.
В цьому випадку ![]() /площа прямокутника/ і тоді I закон термодинаміки:
/площа прямокутника/ і тоді I закон термодинаміки:
![]() .
.
Теплота, що надасться системі, витрачається на зміну внутрішньої енергії і на виконання роботи проти зовнішніх сил.
Молярна теплоємність в ізобаричному процесі ![]() дорівнює
дорівнює
![]() ,
,
але ![]() і тоді
і тоді ![]() . Для одного моля pV = RT
. Для одного моля pV = RT
![]() .
.
Таким чином, ![]() - рівняння Майєра:
- рівняння Майєра:
Молярна теплоємність при сталому тиску більша молярної теплоємності при сталому об’ємі на величину універсальної газової сталої.
3. Ізотермічний процес / Т = const /. Оскільки DE = 0, то DU = 0 – внутрішня енергія газу не змінюється, і тоді ![]() - теплота, що надасться системі в ізотермічному процесі витрачається на роботу розширення газу. Розрахунки показують, що
- теплота, що надасться системі в ізотермічному процесі витрачається на роботу розширення газу. Розрахунки показують, що
![]() .
.
Похожие работы
... Методичні вказівки до лабораторної роботи № З «Тепловіддача горизонтальної труби при вільному русі повітря». Тернопіль 2003 У даних методичних вказівках подані теоретичні основи, опис експернментальної установки і практичні рекомендації лля проведення лабораторної роботи і обробки дослідних даних Мета роботи - засвоїти знання з теорії" конвсктивнот теплообміну при ...
... слабо, лічильник Гейгера реєструє лише невелике число минулих через нього фотонів. Тому ефективність газонаповнених лічильників до цього випромінювання невелика. Ефективнішими для рентгеноструктурних досліджень рідин є сцинтиляційні лічильники. Вони є поєднанням: а) кристала-сцинтилятора йодного натрію, активованого талієм, б) фотоелектронного помножувача (ФЕП); в) попереднього підсилювача на ...
... провідності твердих електролітів ясно відображає специфіку «твердості», оскільки рідкі іонопровідні розчини такого роду анізотропією не володіють. МЕТОДИ ВИЯВЛЕННЯ СУПЕРІОННОЇ ПРОВІДНОСТІ Отже, існування феномена суперіонної проводности твердо встановлене і не викликає ніяких сумнівів. Одночасно з цим очевидна непридатність традиційної й опробованої кількісної теорії для його описання. ...
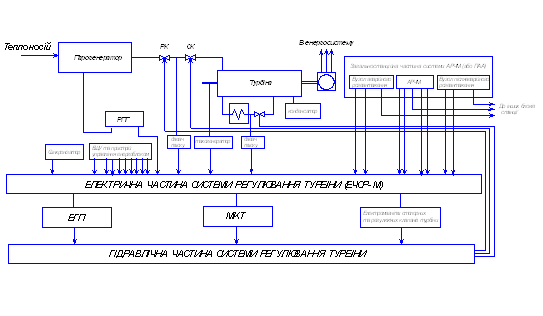
... , звитих в плоскі спіралі. Кінці спіралей приварені до трьох роздаючих і до трьох колекторних труб. 2. Призначення, склад, технічні характеристики системи автоматичного регулювання 2.1 Призначення системи автоматичного регулювання Система автоматичного регулювання (САР) турбіни виконується електрогідравлічною і структурно складається з електричної і гідравлічної частин, робота яких взає ...



0 комментариев